Yderligere information
Anvendelsesområder
Længerevarende renalt betinget hyperfosfatæmi, hvor calciumholdige fosfatbindere må fravælges eller allerede gives i højeste tolerable dosis.
Dispenseringsform
Tyggetabletter. 1 tyggetablet indeholder 500 mg, 750 mg eller 1.000 mg lanthanum (som carbonathydrat).
Doseringsforslag
Voksne. Individuelt:
Initialt 500 mg 3 gange dgl. i forbindelse med måltiderne. Derefter individuelt ud fra P-fosfat med dosisjustering hver 2.-4. uge til højst 3.000 mg (i enkelte tilfælde 4.500 mg) pr. dag.
Bemærk:
- Bør indtages fordelt over dagen sammen med måltiderne.
- Begrænset erfaring vedr. børn og unge < 18 år. Tilgængelige data i SPC.
Håndtering af tabletter og kapsler
| tyggetabletter 500 mg |
| tyggetabletter 750 mg |
| tyggetabletter 1000 mg |
Knusning/åbning
Kan knuses.
Administration
Må ikke synkes hele.
Knust tablet kan opslæmmes i vand.
Tygges.
Mad og drikke
Tages til eller efter mad.
Knust tablet kan kommes på kold, blød mad.
Oplysningerne kan muligvis afvige fra produktresumé. Se endvidere Håndtering af tabletter og kapsler .
Nedsat leverfunktion
Kontraindikationer
Forsigtighedsregler
- P-fosfat skal kontrolleres hver 2.-3. uge, indtil der er opnået et stabilt niveau - og derefter jævnligt.
- P-calcium følges under behandlingen.
- Forsigtighed ved patienter, som er prædisponerede for gastro-intestinal obstruktion, ileus, subileus og perforering fx pga. ændret gastro-intestinal anatomi (divertikulitis, peritonitis, anamnese med gastro-intestinal operation, - cancer og - sår) eller hypomotilitet (fx obstipation eller diabetisk gastroparese).
- Pga. manglende klinisk erfaring bør forsigtighed udvises ved:
- akut mavesår
- aktiv inflammatorisk tarmsygdom
- nedsat peristaltik.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Kvalme, Opkastning |
| Nervesystemet | Hovedpine | |
| Hud og subkutane væv | Allergiske hudreaktioner | |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Dyspepsi, Flatulens, Obstipation | |
| Metabolisme og ernæring | Hypocalcæmi | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Eosinofili | |
| Mave-tarm-kanalen | Paralytisk ileus, Stomatitis, Subileus, Tandgener | Gastroenteritis, Gastro-øsofageal refluks, Mundtørhed, Smagsforstyrrelser, Øsofagitis |
| Almene symptomer og reaktioner på administrationsstedet | Kraftesløshed, Træthed | |
| Undersøgelser | Forhøjede leverenzymer | Vægttab |
| Metabolisme og ernæring | Hypercalcæmi, Hyperfosfatæmi, Hyperglykæmi, Hyperparatyroidisme, Hypofosfatæmi | Nedsat eller øget appetit, Tørst |
| Knogler, led, muskler og bindevæv | Artralgi, Osteoporose | Myalgi |
| Nervesystemet | Svimmelhed | |
| Det reproduktive system og mammae | Smerter i brysterne | |
| Luftveje, thorax og mediastinum | Laryngitis | |
| Hud og subkutane væv | Alopeci | Øget svedtendens |
| Vaskulære sygdomme | Perifere ødemer | |
| Sjældne (0,01-0,1 %) | ||
| Mave-tarm-kanalen | Gastro-intestinal perforation | |
Kliniske aspekter
- De hyppigst indberettede bivirkninger bortset fra hovedpine og allergiske hudreaktioner er af gastro-intestinal art; disse mindskes ved at tage lanthanum til måltider og aftager generelt med tiden, når doseringen fortsættes.
- Allergiske hudreaktioner omfatter bl.a. udslæt, urticaria og pruritus.
- Hyppighed, type og sværhedsgrad af bivirkninger hos børn er ikke fuldstændig fastlagt. Især er der usikkerhed om akkumulation i knogler og risiko for væksthæmning.
- Med ukendt frekvens er identificeret lanthanumaflejringer i den gastro-intestinale mucosa, hovedsageligt efter langvarig brug, og i den gastro-duodenale mucosa med forskellige patologiske karakteristika som inflammation, glandulær atrofi, regenerative forandringer, foveolær hyperplasi, intestinal metaplasi og neoplasi.
Interaktioner
- Gastro-intestinal pH øges. Absorptionen af lægemidler, hvis optagelse er afhængig af pH i ventriklen, fx itraconazol, kan derfor ændres.
- Lanthanum nedsætter biotilgængeligheden af ciprofloxacin med ca. 50 %. Orale fluorquinoloner bør derfor indtages mindst 2 timer før eller 4 timer efter lanthanum.
- Lanthanum nedsætter absorptionen af levothyroxin, som derfor skal indtages mindst 2 timer før eller efter lanthanum.
Graviditet
Baggrund: Der er ingen data, der tillader et meningsfyldt risikoestimat. Absorberes kun i minimalt omfang.
Se også: Klassifikation - graviditet
Amning
Baggrund: Absorberes i minimalt omfang.
Bloddonor
Doping

|
Ingen restriktioner |
Alkohol
Alkohol og Lanthanum "Viatris" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Danner med fosfat i tarmen uopløselige fosfatforbindelser, der udskilles med fæces.
Farmakokinetik
Den systemiske absorption er ringe.
Egenskaber, håndtering og holdbarhed
Holdbarhed
Opbevares beskyttet mod lys.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Hjælpestoffer |
|---|---|---|---|
| tyggetabletter | 500 mg |
Smag
Andre
|
|
| 750 mg |
Smag
Andre
|
||
| 1000 mg |
Smag
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | tyggetabletter
500 mg
Lanthanum "Viatris" |
502659 |
90 stk.
|
1.680,45 | 18,67 | 84,02 | |
| (B) | tyggetabletter
750 mg
Lanthanum "Viatris" |
551161 |
90 stk.
|
2.233,30 | 24,81 | 74,44 | |
| (B) | tyggetabletter
1000 mg
Lanthanum "Viatris" |
381127 |
90 stk.
|
2.959,50 | 32,88 | 73,99 |
Foto og identifikation
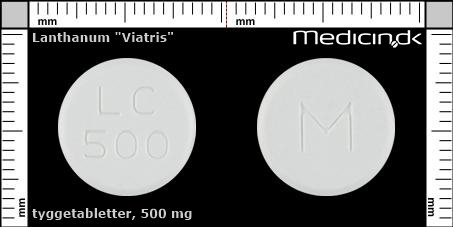
Tyggetabletter 500 mg |
| Præg: |
M, LC, 500
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 14,3 x 14,3 |
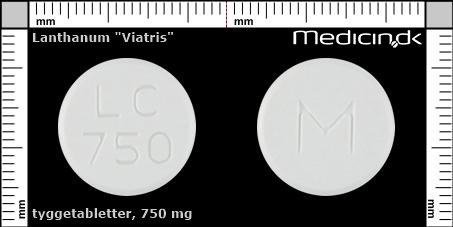
Tyggetabletter 750 mg |
| Præg: |
M, LC, 750
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 17,3 x 17,3 |
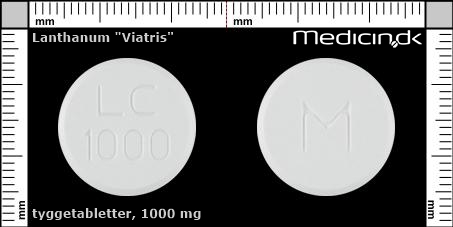
Tyggetabletter 1000 mg |
| Præg: |
M, LC, 1000
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 19,3 x 19,3 |
Referencer
1550. SPC, Lægemiddelstyrelsen. , http://www.produktresume.dk (Lokaliseret 19. januar 2026)
3966. SPC, EMA. European Medicines Agency. , https://www.ema.europa.eu/en/medicines (Lokaliseret 6. februar 2024)
Der kan forekomme forskelle mellem lægemiddelbeskrivelsen og indlægssedlen eller det myndighedsgodkendte produktresumé. Det skyldes, at Medicin.dk kan have suppleret Lægemiddelstyrelsens og medicinvirksomhedernes information med andre kilder. Lægemiddelbeskrivelsen og anden information i Medicin.dk’s produkter er til generel vejledning og kan ikke erstatte professionel medicinsk rådgivning.
Konsulter altid en læge eller anden sundhedsprofessionel ved spørgsmål om medicin, dosering eller behandling.
Læs mere om Brugervilkår og ansvar .



