Generel information
Immunmodulerende middel med antiinflammatoriske egenskaber til behandling af attakvis (recidiverende-remitterende) multipel sklerose (RRMS).
Anvendelsesområder
Behandling af patienter med aktiv attakvis multipel sklerose (MS), dvs. attak eller tegn på aktivitet på MR-scanning af hjernen og/eller rygmarv inden for det sidste år.
Dispenseringsform
Kapsler. 1 kapsel indeholder 120 mg eller 240 mg dimethylfumarat.
Doseringsforslag
Voksne og børn over 13 år
- Initialt 120 mg 2 gange dgl. Efter 7 dage øges dosis til den anbefalede dosis på 240 mg 2 gange dgl.
Bemærk:
- Erfaring savnes vedr. behandling af patienter over 55 år eller under 10 år.
Glemt medicin
- Ved glemt dosis må der ikke tages dobbeltdosis, medmindre doserne kan tages med mindst 4 timers interval indtil næste planlagte dosis.
Håndtering af kapsler og tabletter
| enterokapsler 120 mg, Biogen |
| enterokapsler 240 mg, Biogen |
Mad og drikke
Tages med et glas vand.
Tages til et måltid.
Knusning/åbning
Må ikke åbnes.
Administration
Synkes hele.
Må ikke tygges.
OBS
Kan også tages umiddelbart efter et måltid.
Se endvidere Håndtering af tabletter og kapsler.
Kontraindikationer
Formodet eller bekræftet progressiv multifokal leukoencefalopati (PML).
Forsigtighedsregler
- Patienter med lave lymfocyttal
- Inden behandlingsstart bør der foreligge en nylig foretaget komplet blodtælling (dvs. inden for de sidste 3 måneder) og gentages hver 3. måned i hele behandlingsforløbet. Behandling bør afbrydes hos patienter med lymfocyttal < 0,5 x 109/l i mere end 6 måneder pga. risikoen for udvikling af PML (progressiv multifokal leukoencefalopati). Behandlingen kan genoptages, når lymfocyttallet er normaliseret. Symptomer på PML kan ligne et MS-attak, udvikles i løbet af dage til uger og omfatter progressiv svaghed i den ene side af kroppen eller klodsethed af lemmer, synsforstyrrelser og ændret tankegang, hukommelse og orientering, hvilket fører til forvirring og personlighedsændringer.
- Patienter med alvorlig infektion bør ikke starte behandling, før infektionen er overstået.
- Såfremt en patient udvikler en alvorlig infektion, skal det overvejes at seponere behandlingen, og fordele og risici skal revurderes, før behandlingen genoptages.
- Patienter skal informeres om at rapportere symptomer på infektion til en læge.
- Lægemiddelinduceret leverskade, herunder forhøjede leverenzymer (≥ 3 øvre normalgrænse og forhøjede niveauer af totalt bilirubin), kan forekomme som følge af behandling med dimethylfumarat. Dette kan opstå umiddelbart, efter adskillige uger eller efter længere tid og ophører efter seponering af behandlingen. En vurdering af niveauerne af serum-amino-transferaser (ALAT, ASAT og totalt bilirubin) anbefales før behandlingsstart og under behandlingen.
- Patienterne bør overvåges for tegn og symptomer på herpes zoster, især hvis der er rapporteret samtidig lymfopeni.
Bivirkninger
Rødme og gastro-intestinale gener er tilbøjelige til at opstå tidligt i behandlingen (primært den første måned) og hos ca. 85 % svinder symptomerne inden for 6 måneder. Hos patienter, der får disse bivirkninger, kan de forekomme med mellemrum under den fortsatte behandling.
En midlertidig dosisreduktion til 120 mg 2 gange daglig og/eller indtagelse af kapslen sammen med mad kan reducere forekomsten.
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Kvalme |
| Undersøgelser | Ketonstoffer i urinen | |
| Vaskulære sygdomme | Flushing (rødme) | |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Leukopeni, Lymfopeni | Leukocytose, Lymfocytose |
| Mave-tarm-kanalen | Dyspepsi, Gastritis, Gastroenteritis, Opkastning | |
| Almene symptomer og reaktioner på administrationsstedet | Brændende fornemmelse | |
| Undersøgelser | Forhøjede levertransaminaser (ALAT/ASAT) | |
| Nervesystemet | Hyperæstesi | |
| Nyrer og urinveje | Albuminuri | Proteinuri |
| Hud og subkutane væv | Alopeci, Erytem | Hudkløe, Hududslæt |
| Vaskulære sygdomme | Hedeture, Varmefølelse | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Trombocytopeni | |
| Immunsystemet | Anafylaktisk reaktion, Hypersensitivitet | |
| Ikke kendt hyppighed | ||
| Almene symptomer og reaktioner på administrationsstedet | Hypoxi | |
| Lever og galdeveje | Hepatotoksicitet | |
| Immunsystemet | Angioødem | |
| Infektioner og parasitære sygdomme | Herpes zoster*, Progressiv multifokal leukoencefalopati (PML) | |
| Luftveje, thorax og mediastinum | Dyspnø | Rhinoré |
| Vaskulære sygdomme | Hypotension | |
Der er indberettet tilfælde af Fanconis syndrom for et lægemiddel indeholdende dimethylfumarat i kombination med andre fumarsyreestere. En tidlig diagnosticering af Fanconis syndrom og seponering af dimethylfumarat-behandlingen er vigtig for at forhindre opståen af nyreinsufficiens og osteomalaci, da syndromet normalt er reversibelt.
* Der er forekommet tilfælde af herpes zoster, de fleste ikke alvorlige, men der er også indberettet alvorlige tilfælde, herunder dissemineret herpes zoster, herpes zoster ophthalmicus, herpes zoster oticus, neurologisk herpes zoster-infektion, herpes zoster-meningoencephalitis og herpes zoster-meningomyelitis. Disse tilfælde kan forekomme når som helst under behandlingen.
Kliniske aspekter
Forstyrrelser i mave-tarm-kanalen samt i luftveje, thorax og mediastinum og uønskede hændelser såsom hovedpine og dysmenorré blev indberettet hyppigere (≥ 10%) hos den pædiatriske population end hos den voksne population.
Interaktioner
- Samtidig brug af andre fumarsyrederivater (topikale eller systemiske) bør undgås.
- Samtidig behandling med nefrotoksiske lægemidler (fx aminoglykosider, diuretika, NSAID eller lithium) kan øge risikoen for renale bivirkninger.
- Stærke alkoholiske drikke (mere end 30 volumen-% alkohol) bør undgås inden for en time efter indtagelse af orale fumarater, da alkohol kan medføre en øget hyppighed af gastrointestinale bivirkninger.
Graviditet
Baggrund:
Det samlede antal eksponerede under graviditeten er usikkert på grund af overlappende datakilder. Skønsmæssigt er det omkring 600 eksponerede levendefødte børn. Hyppigheden af spontanabort synes let øget.
Der er ikke tegn på en væsentlig øget risiko for medfødte misdannelser.
De forskellige publikationer og producentens data overlapper i et ukendt - men næppe ubetydeligt - omfang.
Producenten refererer i produktresuméet til data for omkring 300 gravide (heraf har formentlig en væsentlig andel været en del af andre publikationer) i en intern database, som har været eksponeret under graviditeten uden tegn på uønsket fosterpåvirkning.
Amning
Bloddonor
Alkohol
Alkohol og Tecfidera påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
- Virkningsmekanismen er ikke fuldstændig klarlagt. Reducerer signifikant immuncelleaktiveringen og den efterfølgende frigivelse af pro-inflammatoriske cytokiner som respons på inflammatoriske stimuli.
- Dimethylfumarat har vist at sænke middel-lymfocyttallet i gennemsnit med cirka 30 % i forhold til baseline-værdien i løbet af det første år af behandlingen med et efterfølgende plateau.
Farmakokinetik
- Maksimal plasmakoncentration efter 2-2½ time.
- Fordelingsvolumen 0,86-1,29 l/kg.
- Plasmahalveringstid ca. 1 time.
- Udskilles primært som CO2 (ca. 60 % af dosis). Resten udskilles gennem nyrerne og med fæces.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| enterokapsler | 120 mg |
Farve
Andre
|
|
| 240 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | enterokapsler
120 mg
Tecfidera |
392438 |
14 stk. (blister)
|
2.942,50 | 210,18 | 840,71 | |
| (BEGR) | enterokapsler
240 mg
Tecfidera |
400574 |
56 stk. (blister)
|
11.534,95 | 205,98 | 411,96 | |
| (BEGR) | enterokapsler
240 mg
Tecfidera |
400912 |
56 stk. (blister) (Orifarm)
|
14.521,90 | 259,32 | 518,64 |
Foto og identifikation
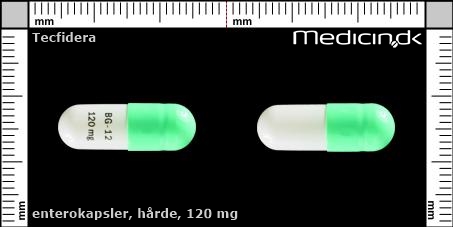
Enterokapsler 120 mg |
| Præg: |
BG-12 120 mg
|
| Kærv: | Ikke relevant |
| Farve: | Grøn, Hvid |
| Mål i mm: | 7 x 21 |
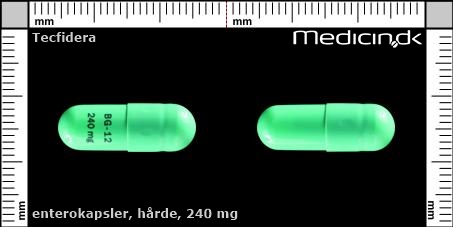
Enterokapsler 240 mg |
| Præg: |
BG-12 240 mg
|
| Kærv: | Ikke relevant |
| Farve: | Grøn |
| Mål i mm: | 7 x 21 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
6064. Khan E, Kagzi Y, Elkhooly M et al. Disease modifying therapy and pregnancy outcomes in multiple sclerosis: A systematic review and meta-analysis. J Neuroimmunol. 2023, https://pubmed.ncbi.nlm.nih.gov/37672841/ (Lokaliseret 5. januar 2024)
6065. Andersen JB, Sellebjerg F, Magyari M. Pregnancy outcomes after early fetal exposure to injectable first-line treatments, dimethyl fumarate, or natalizumab in Danish women with multiple sclerosis. Eur J Neurol. 2023; 30(1):162-71, https://pubmed.ncbi.nlm.nih.gov/36098960/ (Lokaliseret 5. januar 2024)
6067. Hellwig K, Rog D, McGuigan C et al. Interim Analysis of Pregnancy Outcomes After Exposure to Dimethyl Fumarate in a Prospective International Registry. Neurol Neuroimmunol Neuroinflamm. 2021; 9(1), https://pubmed.ncbi.nlm.nih.gov/34815321/ (Lokaliseret 5. januar 2024)
6066. Vukusic A, Coyle PK, Jurgensen S et al. Pregnancy outcomes in patients with multiple sclerosis treated with teriflunomide: Clinical study data and 5 years of post-marketing experience. Mult Scler. 2020; 26(7):829-36, https://pubmed.ncbi.nlm.nih.gov/30968734/ (Lokaliseret 5. januar 2024)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



