Yderligere information
Generel information
Svampemiddel til systemisk anvendelse.
Anvendelsesområder
- Hud- og negleinfektioner forårsaget af terbinafinfølsomme svampe.
- MIC-værdierne for Candida albicans og Malassezia sp. er væsentligt højere end for dermatofytter, hvorfor systemisk (oral) behandling derfor er fortrinsvis indiceret ved dermatofytoser. Se endvidere tabel 1 i Svampeinfektioner i huden.
Dispenseringsform
Tabletter. 1 tablet indeholder 250 mg (delekærv) terbinafin (som hydrochlorid).
Doseringsforslag
Mykoser i hud og negle
- Voksne. 250 mg én gang dgl.
- Behandlingsvarighed ved hudinfektioner sædvanligvis 2-4 uger
- For fingernegle sædvanligvis 6 uger
- For tånegle 12 uger.
Bemærk:
- Børn med mykoser i hud, typisk dermatofytosis capitis og evt. negle kan behandles med terbinafin 125 mg tablet efter vægt. Denne styrke af terbinafin er ikke markedsført i Danmark og kræver derfor udleveringstilladelse fra Lægemiddelstyrelsen.
Håndtering af kapsler og tabletter
| tabletter 250 mg, Parallelimport (Nordic Prime ApS) Delekærv |
Mad og drikke
Tages med et glas vand.
Kan tages med eller uden mad.
Knust tablet kan kommes på kold, blød mad.
Knusning/åbning
Kan knuses.
Administration
Knust tablet kan opslæmmes i vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Dosisjustering
- GFR: 0-50 ml/min.
- Alder: ≥17 år
- Dosis: >125 mg
Dosis reduceres til 50 % af normaldosis. Højst 125 mg 1 gang dgl. under monitorering af bivirkninger.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
- Dosis bør nedsættes ved let nedsat leverfunktion.
- Kontraindiceret ved moderat til stærkt nedsat leverfunktion.
Forsigtighedsregler
- Terbinafin synes at kunne provokere såvel kutan som systemisk lupus erythematosus og er relativt kontraindiceret hos denne patientkategori.
- I meget sjældne tilfælde kan ses forværring af psoriasis.
- Leverfunktionen bør monitoreres (efter 4-6 ugers behandling), da levertoksicitet kan opstå uden eksisterende leversygdom.
- Ved tegn på leverinsufficiens bør behandlingen ophøre.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Kvalme |
| Immunsystemet | Urticaria | |
| Metabolisme og ernæring | Mæthedsfornemmelse | Nedsat appetit |
| Knogler, led, muskler og bindevæv | Artralgi | Myalgi |
| Nervesystemet | Hovedpine | |
| Hud og subkutane væv | Hududslæt | |
| Almindelige (1-10 %) | ||
| Øjne | Synsforstyrrelser | |
| Mave-tarm-kanalen | Smagsforstyrrelser | |
| Almene symptomer og reaktioner på administrationsstedet | Træthed | |
| Nervesystemet | Svimmelhed | |
| Psykiske forstyrrelser | Depression (muligvis som følge af smagsforstyrrelser) | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Anæmi | |
| Øre og labyrint | Tinnitus | |
| Nervesystemet | Paræstesier | |
| Sjældne (0,01-0,1 %) | ||
| Lever og galdeveje | Hepatitis, Kolestase, Leverpåvirkning | Icterus |
| Meget sjældne (< 0,01 %) | ||
| Blod og lymfesystem | Agranulocytose, Trombocytopeni | |
| Lever og galdeveje | Leverinsufficiens* | |
| Immunsystemet | Anafylaktisk reaktion, Forværring af psoriasis, Stevens-Johnsons syndrom | |
| Knogler, led, muskler og bindevæv | Kutan lupus erythematosus-lignende reaktion (SLE) | |
| Hud og subkutane væv | Erythema multiforme, Hårtab, Toksisk epidermal nekrolyse (TEN) | |
| Ikke kendt hyppighed | ||
| Øre og labyrint | Høretab | |
| Knogler, led, muskler og bindevæv | Rhabdomyolyse | |
| Luftveje, thorax og mediastinum | Anosmi (inkl. permanent anosmi) | |
* Der er observeret leversvigt efterfulgt af levertransplantation eller død. I de fleste tilfælde led disse patienter af anden alvorlig underliggende sygdom.
Kliniske aspekter
Bemærk at en utilstrækkelig behandlingsvarighed kan medføre recidiv af den aktive infektion. Ved længerevarende behandling anbefales kontrol af lever- og knoglemarvspåvirkning. Kan I sjældne tilfælde fremkalde alvorlige hudreaktioner i form af Stevens-Johnsons syndrom eller toksisk epidermal nekrolyse.
Interaktioner
- Rifampicin øger omsætningshastigheden af terbinafin.
- Terbinafin hæmmer CYP2D6 og øger dermed plasmakoncentrationen af tricykliske antidepressiva og sandsynligvis andre lægemidler, som nedbrydes af dette enzym (fx β-blokkere, SSRI-præparater, antiarytmika og MAO-hæmmere), se tabel 2 i Elimination og cytokrom P450-systemet.
- Fluconazol øger Cmax og AUC for terbinafin med respektivt 52 % og 69 % på grund af hæmning af både CYP2C9 og CYP3A4-enzymer. Terbinafin påvirker ikke fluconazols farmakokinetik. Lignende øgning i plasmakoncentrationen kan ske, når andre hæmmere af både CYP2C9 og CYP3A4 (fx amiodaron), gives samtidig med terbinafin.
- Terbinafin kan nedsætte effekten af hhv. dextromethorphan og ciclosporin.
- Ændringer i INR og/eller protrombintid er observevet hos patienter, der samtidig behandles med warfarin.
Graviditet
Baggrund: Der er data for ca. 100 1. trimester-eksponerede uden tegn på overhyppighed af uønsket fosterpåvirkning. Den begrænsede datamængde tillader ikke at udelukke en øget risiko.
Amning
Baggrund: Den relative vægtjusterede dosis er ca. 4 %. Der er ikke beskrevet bivirkninger hos barnet.
Bloddonor
Ingen karantæne ved tapning af plasma til fraktionering.
Alkohol
Alkohol og Terbinafin "Nordic Prime" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Farmakokinetik
- Biotilgængelighed 50-85 %.
- Maksimal plasmakoncentration efter ca. 2 timer.
- Bindes til hud, hår, negle og fedtvæv.
- Metaboliseres i udstrakt grad i leveren til inaktive metabolitter.
- Plasmahalveringstid 17-30 timer.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| tabletter | 250 mg (Nordic Prime ApS) |
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | tabletter
250 mg
(Nordic Prime ApS)
(kan dosisdisp.)
Terbinafin "Nordic Prime" |
100268 |
28 stk. (blister)
|
169,45 | 6,05 | 6,05 | |
| (B) | tabletter
250 mg
(Nordic Prime ApS)
(kan dosisdisp.)
Terbinafin "Nordic Prime" |
118739 |
98 stk. (blister)
|
350,75 | 3,58 | 3,58 |
Substitution
| tabletter 250 mg |
|---|
| Terbinafin "Actavis" TEVA, Terbinafin, tabletter 250 mg |
| Terbinafin "Epione Medicine" (Parallelimport), Terbinafin, tabletter 250 mg |
| Terbinafin "Medical Valley" Medical Valley, Terbinafin, tabletter 250 mg |
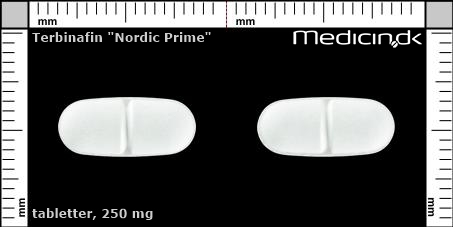
Foto og identifikation
Tabletter 250 mg (Nordic Prime ApS) |
| Præg: |
Intet præg
|
| Kærv: | Delekærv |
| Farve: | Hvid |
| Mål i mm: | 6,3 x 14,2 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
4062. Sarkar MS, Rowland K, Koren G. Pregnancy outcome following gestational exposure to terbinafine: a prospective comparative study. Birth Defects Res, Part A: Clinical and Molecular Teratology. 2003; 67:390, https://hero.epa.gov/hero/index.cfm/reference/details/reference_id/1471014 (Lokaliseret 24. februar 2022)
3772. UpToDate. Wolters Kluwer. , https://www.uptodate.com (Lokaliseret 24. februar 2022)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



