Generel information
Anvendelsesområder
- Forebyggelse af organafstødning med lav til moderat immunologisk risiko efter nyretransplantation.
- Sporadisk lymfangioleiomyomatose (S-LAM) med moderat lungesygdom eller faldende lungefunktion.
Sirolimus bør kun anvendes, når behandlingen forestås af læger med særlig kendskab til organtransplantationer.
Dispenseringsform
Tabletter. 1 tablet (overtrukken) indeholder 1 mg eller 2 mg sirolimus.
Oral opløsning. 1 ml indeholder 1 mg sirolimus.
Doseringsforslag
Forebyggelse af organafstødning
- Initialbehandling
Voksne. Initialt 6 mg én gang efterfulgt af 2 mg dgl. Dosis justeres til fuldblodskoncentration på 4-7 nanogram/ml.
Skal anvendes i kombination med kortikosteroid og calcineurinhæmmer som mikroemulsion, hvor calcineurinhæmmer seponeres gradvist over 2-3 mdr. - Vedligeholdelsesbehandling
Calcineurinhæmmer bør aftrappes i løbet af 4-8 uger, hvorefter dosis af sirolimus justeres til laveste fuldblodskoncentration på 12-20 nanogram/ml. Ved skift af dispenseringsform bør blodkoncentrationen måles 1-2 uger efter skiftet. Se endvidere speciallitteratur. - Bemærk:
- Bør indtages 4 timer efter ciclosporin og konsekvent med eller uden mad.
Lymfangioleiomyomatose
- Initialbehandling
2 mg dgl. Dosis justeres til fuldblodskoncentration 5-15 ng/ml. - Vedligeholdelsesbehandling
Når vedligeholdelsesdosis er justeret (se produktresumé) skal yderligere dosisjustering undgås i 1-2 uger pga. sirolimus' lange halveringstid. Herefter lægemiddelmonitorering hver 3. måned.
Bemærk:
- Tabletterne synkes hele med et glas vand.
- Må ikke knuses eller tygges.
- Tages konsekvent med mad eller uden mad.
- Utilstrækkelig erfaring vedr. børn < 18 år og ældre > 65 år.
Håndtering af kapsler og tabletter
| overtrukne tabletter 1 mg, Pfizer Ingen kærv |
| overtrukne tabletter 2 mg, Pfizer Ingen kærv |
Mad og drikke
Tages med et glas vand.
Tages konsekvent med mad eller uden mad.
Knusning/åbning
Må ikke knuses.
Administration
Synkes hele.
Må ikke tygges.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat leverfunktion
- Forsigtighed tilrådes.
- Vedligeholdelsesdosis bør halveres ved stærkt nedsat leverfunktion.
- Tæt monitorering af dalkoncentrationen i fuldblod efter støddosis eller dosisjustering tilrådes.
Forsigtighedsregler
- Under behandlingen monitoreres regelmæssigt for neoplasmer i huden. Det tilrådes patienten at minimere udsættelse for UV-lys og sollys samt anvende relevant solbeskyttelse.
- Vaccination med levende vaccine skal undgås.
Hjælpestoffer
- Alkohol. Oral opløsning indeholder 2,5 % v/v alkohol. 1 dosis på 6 mg indeholder 0,15 g alkohol, der svarer til 1,3 % af én genstand.
- Soja. Oral opløsning indeholder soja. Læs mere om soja og overfølsomhed.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Blod og lymfesystem | Anæmi, Leukopeni, Lymfocele, Trombocytopeni | |
| Hjerte | Takykardi | |
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Kvalme, Obstipation |
| Almene symptomer og reaktioner på administrationsstedet | Sårhelingskomplikationer | Feber |
| Infektioner og parasitære sygdomme | Infektioner | |
| Undersøgelser | Forhøjede leverenzymer, Forhøjet plasma-kreatinin | |
| Metabolisme og ernæring | Diabetes, Hyperglykæmi, Hyperkolesterolæmi, Hypertriglyceridæmi, Hypofosfatæmi, Hypokaliæmi | |
| Knogler, led, muskler og bindevæv | Artralgi | |
| Nervesystemet | Hovedpine | |
| Nyrer og urinveje | Urinvejsinfektion | Proteinuri |
| Det reproduktive system og mammae | Menstruationsforstyrrelser | |
| Hud og subkutane væv | Acne, Hududslæt | |
| Vaskulære sygdomme | Hypertension, Perifere ødemer, Ødemer | |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Neutropeni, Pancytopeni | |
| Hjerte | Perikardieansamling | |
| Mave-tarm-kanalen | Ascites, Pancreatitis, Stomatitis | |
| Immunsystemet | Allergiske reaktioner, Anafylaktisk reaktion, Angioødem | |
| Infektioner og parasitære sygdomme | Sepsis | |
| Knogler, led, muskler og bindevæv | Osteonekrose | |
| Benigne, maligne og uspecificerede neoplasmer | Hudcancer, Ovariecyster | |
| Nyrer og urinveje | Hæmolytisk uræmisk syndrom | |
| Luftveje, thorax og mediastinum | Pleuraekssudat | Epistaxis |
| Vaskulære sygdomme | Dyb venetrombose, Lungeemboli | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Lymfom | |
| Lever og galdeveje | Leverinsufficiens | |
| Benigne, maligne og uspecificerede neoplasmer | Malignt melanom | |
| Nyrer og urinveje | Nefrotisk syndrom | |
| Hud og subkutane væv | Eksfoliativ dermatitis, Trombocytopenisk purpura | |
| Vaskulære sygdomme | Lungeblødning | Lymfødem |
| Ikke kendt hyppighed | ||
| Nervesystemet | Posterior reversibelt encefalopati-syndrom | |
Kliniske aspekter
- Ved brug af immundæmpende præparater er det velkendt, at der er øget risiko for infektioner.
- Langvarig behandling kan medføre en let øget cancer-risiko, især lymfeknude- og hudkræft.
Interaktioner
- Samtidig indgift af ciclosporin, diltiazem eller itraconazol øger fuldblodskoncentrationen af sirolimus.
- Samtidig indgift af rifampicin nedsætter fuldblodskoncentrationen af sirolimus.
- Samtidig administration af ACE-hæmmere øger risikoen for angioødem og for akut afstødning.
- Sirolimus metaboliseres via CYP3A4. Der er derfor teoretisk risiko for interaktioner med lægemidler, der metaboliseres af samme enzym (fx antimykotika, makrolider eller steroider), hvor samtidig behandling kan øge eller reducere sirolimus-koncentrationen, se tabel 2 i Elimination og cytokrom P450-systemet.
- Naturlægemidler med perikon kan nedsætte plasma-koncentrationen af sirolimus.
- Forsigtighed ved samtidig indgift af cannabidiol (P-gp-hæmmer) da dette kan give forhøjet sirolimus niveau i blodet.
- Må ikke indtages sammen med grapefrugtjuice.
- Ved samtidig brug af sunitimab kan dosisbegrænsende toksicitet af sirolimus forekomme (makulopapuløst hududslæt, anfald af arthritis urica og cellulitis).
Graviditet
Baggrund: Der er ikke humane data, som tillader et meningsfyldt risikoestimat.
Se også Klassifikation - graviditet
Fertile kvinder og mænd
Kvinder i den fertile alder bør anvende sikker antikonception under behandlingen og i mindst 12 uger efter afslutning af behandlingen.
Amning
På grund af virkningsmekanismen frarådes amning.
Bloddonor
Alkohol
Alkohol og Rapamune® påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Sirolimus virker hæmmende på de T-lymfocytmedierede immunreaktioner, men angrebspunktet er en hæmning af de signaltransduktionsveje, som proinflammatoriske cytokiner udløser frem for en hæmning af cytokinproduktionen.
Farmakokinetik
- Biotilgængelighed ca. 15 % ved samtidig ciclosporinbehandling.
- Maksimal plasmakoncentration efter 1-2 timer.
- Steady state efter 5-7 dage.
- Høj erytrocytbinding.
- Metaboliseres næsten fuldstændigt i leveren via CYP3A4 til aktive metabolitter (< 10 % af den samlede immunsupprimerende aktivitet).
- Metabolitterne udskilles hovedsageligt med galden.
Egenskaber, håndtering og holdbarhed
Håndtering
- Oral opløsning skal fortyndes med vand eller appelsinjuice, ikke grapefrugtjuice.
- Omrøres kraftigt.
- Drikkes med det samme.
- Se medfølgende brugsvejledning.
Holdbarhed
Oral opløsning
- Opbevares i køleskab (2-8 °C) beskyttet mod lys.
- Efter åbning: Flasken er holdbar i 30 dage opbevaret i køleskab (2-8 ºC).
- Tåler opbevaring i doseringssprøjten i højst 24 timer ved stuetemperatur (højst 25 °C).
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| oral opløsning | 1 mg/ml |
Andre
|
|
| overtrukne tabletter | 1 mg |
Farve
Andre
|
|
| 2 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | overtrukne tabletter
1 mg
Rapamune |
534471 |
100 stk. (blister)
|
3.022,10 | 30,22 | 90,66 | |
| (BEGR) | overtrukne tabletter
2 mg
Rapamune |
502002 |
100 stk. (blister)
|
6.022,45 | 60,22 | 90,34 | |
| (BEGR) | oral opløsning
1 mg/ml
Rapamune |
136181 |
60 ml
|
1.816,40 | 30,27 | 90,82 |
Foto og identifikation
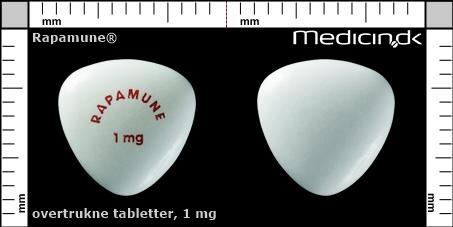
Overtrukne tabletter 1 mg |
| Præg: |
RAPAMUNE, 1 mg
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 9,9 x 9,9 |
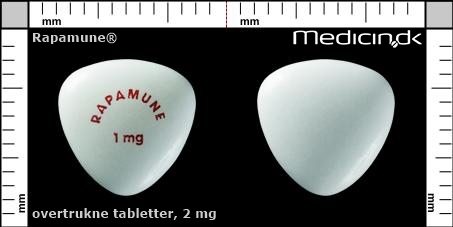
Overtrukne tabletter 2 mg |
| Præg: |
RAPAMUNE, 2 mg
|
| Kærv: | Ingen kærv |
| Farve: | Lysegul |
| Mål i mm: | 9,9 x 9,9 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
4277. Kamarajah SK, Arntdz K, Bundred J et al. Outcomes of Pregnancy in Recipients of Liver Transplants. Clin Gastroenterol Hepatol. 2018, https://www.ncbi.nlm.nih.gov/pubmed/30529735 (Lokaliseret 24. februar 2022)
4278. Colla L, Diena D, Rossetti M et al. Immunosuppression in pregnant women with renal disease: review of the latest evidence in the biologics era. J Nephrol. 2018; 31(3):361-83, https://www.ncbi.nlm.nih.gov/pubmed/29476421 (Lokaliseret 24. februar 2022)
4279. Sarkar M, Bramham K, Moritz MJ et al. Reproductive health in women following abdominal organ transplant. Am J Transplant. 2018; 18(5):1068-76, https://www.ncbi.nlm.nih.gov/pubmed/29446243 (Lokaliseret 24. februar 2022)
4281. Bramham K, Nelson-Piercy C, Gao H et al. Pregnancy in renal transplant recipients: a UK national cohort study. Clin J Am Soc Nephrol. 2013; 8(2):290-8, https://www.ncbi.nlm.nih.gov/pubmed/23085724 (Lokaliseret 24. februar 2022)
4280. Deshpande NA, James NT, Kucirka LM et al. Pregnancy outcomes of liver transplant recipients: a systematic review and meta-analysis. Liver Transpl. 2012; 18(6):621-9, https://www.ncbi.nlm.nih.gov/pubmed/22344967 (Lokaliseret 24. februar 2022)
1550. SPC, Lægemiddelstyrelsen. , http://www.produktresume.dk (Lokaliseret 17. marts 2023)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)
3966. SPC, EMA. European Medicines Agency. , https://www.ema.europa.eu/en/medicines (Lokaliseret 6. februar 2024)



