Anvendelsesområder
- Jernoverskud hos patienter med β-thalassaemia major, hvor monoterapi med andet jernchelerende middel er utilstrækkelig.
En række studier har vist en særlig gunstig effekt hos patienter med kardiel siderose. I disse tilfælde anbefales deferipron i kombination med deferoxamin.
Deferipron bør kun anvendes, når behandlingen forestås af læger med særlig indsigt i behandling af thalassæmi.
Dispenseringsform
Tabletter. 1 tablet (filmovertrukken) indeholder 500 mg (delekærv) eller 1.000 mg (delekærv) deferipron.
Doseringsforslag
Voksne og børn > 10 år
- 25 mg/kg legemsvægt 3 gange dgl.
- Doser > 100 mg/kg legemsvægt/døgn giver øget risiko for bivirkninger.
Ved neutropeni seponeres behandlingen, og fuldstændigt blodbillede kontrolleres dgl. Efter bedring af blodbilledet bør det kontrolleres fuldstændigt ugentligt de følgende 3 uger. Fornyet behandling anbefales ikke. - En velcheleret patient har P-ferritin < 1.000 mikrogram/l.
- Kombinationsterapi frarådes ved S-ferritin < 500 mikrogram/l pga. risiko for overdreven jernfjernelse.
Bemærk:
- Der er begrænset erfaring vedr. behandling af børn 6-10 år og ingen erfaring vedr. behandling af børn < 6 år.
- Der er kun begrænsede data vedr. kombinationsbehandling med deferipron og deferasirox, og der skal udvises forsigtighed, når det overvejes at anvende denne kombination.
Håndtering af tabletter og kapsler
| filmovertrukne tabletter 500 mg |
| filmovertrukne tabletter 1000 mg |
Knusning/åbning
Kan knuses.
Administration
Knust tablet kan opslæmmes i vand.
Mad og drikke
Tages med et glas vand.
Kan tages med eller uden mad.
Knust tablet kan kommes på kold, blød mad.
Oplysningerne kan muligvis afvige fra produktresumé. Se endvidere Håndtering af tabletter og kapsler .
Nedsat leverfunktion
Kontraindikationer
- Recidiverende neutropeni eller agranulocytose i anamnesen.
- Patienter med leukopeni/neutropeni udløst af grundsygdommen, fx MDS, som har indikation for jernchelering, bør overvejes behandlet med et af de alternative jernchelerende midler grundet øget risiko for forværret leukopeni.
- Behandling med lægemidler, der kan forårsage neutropeni eller agranulocytose.
Forsigtighedsregler
- Behandlingen foretages under regelmæssig kontrol af lever- og nyrefunktion samt af granulocyttal.
- Patienten skal informeres om at afbryde behandlingen og kontakte sin behandlende læge ved tegn til infektion.
- Det anbefales kraftigt, at behandlingen ikke påbegyndes ved eksisterende neutropeni.
- Plasma-ferritin og plasma-zink kontrolleres regelmæssigt.
- Pga. den variable behandlingseffekt er nøje monitorering af jernstatus og hjertefunktion nødvendig.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Kvalme, Opkastning |
| Nyrer og urinveje | Misfarvning af urinen | |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Agranulocytose, Neutropeni | |
| Mave-tarm-kanalen | Diarré | |
| Almene symptomer og reaktioner på administrationsstedet | Træthed | |
| Undersøgelser | Forhøjede leverenzymer | |
| Metabolisme og ernæring | Øget appetit | |
| Knogler, led, muskler og bindevæv | Artralgi | |
| Nervesystemet | Hovedpine | |
| Ikke kendt hyppighed | ||
| Immunsystemet | Allergiske reaktioner | Urticaria |
| Hud og subkutane væv | Hududslæt | |
Kliniske aspekter
- Gastrointestinale bivirkninger ses hyppigere i begyndelsen af behandlingen og ophører for det meste inden for nogle få uger, uden at behandlingen seponeres. Hos nogle patienter kan det være gavnligt at reducere deferiprondosis og dernæst skalere den tilbage op til den tidligere dosis.
- Artroser, der strakte sig fra lettere smerter i et eller flere led og op til alvorlig arthritis med effusion og signifikant funktionsnedsættelse er ligeledes blevet rapporteret. Lettere artroser er generelt forbigående.
- Forekomsten af bivirkninger hos 18 børn og 97 voksne var ikke signifikant forskellig mellem de to aldersgrupper, undtagen forekomst af artrose (11,1 % hos børn vs. ingen hos voksne).
- Episoder med hypo- eller hypertoni er rapporteret hos børn. De neurologiske forstyrrelser svandt gradvist efter seponering.
- Den alvorligste rapporterede bivirkning var agranulocytose, defineret som et absolut neutrofiltal på mindre end 0,5 x 109/l, som opstod hos ca. 1 % af patienterne. Mindre alvorlige anfald af neutropeni blev rapporteret hos ca. 5 % af patienterne.
Graviditet
Se også: Klassifikation - graviditet
Fertile kvinder og mænd
Produktresumeet angiver, baseret på prækliniske data, at kvinder i den fertile alder skal anvende sikker kontraception og undgå at blive gravide, mens de behandles med deferipron og i 6 måneder efter behandlingen er gennemført.
Amning
Bloddonor
Doping

|
Ingen restriktioner |
Alkohol
Alkohol og Ferriprox® påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Danner kompleks med frit jern i plasma eller celler. Komplekset udskilles fuldstændigt via urin og fæces og reducerer derved den patologiske oplagring af jern i organerne.
Farmakokinetik
- Absorberes hurtigt fra mave-tarm-kanalen.
- Maksimal plasmakoncentration efter 45-60 min.
- Inaktiveres i leveren ved konjugering til glucuronsyre.
- Glucuronsyrederivat binder ikke jern.
- Glucuronideringsfraktionen er varierende og kan forklare en variabel klinisk effekt.
- Plasmahalveringstid 2-3 timer.
- Danner opløseligt jernchelat, som hovedsageligt udskilles gennem nyrerne.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 500 mg |
Farve
Andre
|
|
| 1000 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | filmovertrukne tabletter
500 mg
(kan dosisdisp.)
Ferriprox |
003687 |
100 stk.
|
2.154,65 | 21,55 | ||
| (BEGR) | filmovertrukne tabletter
1000 mg
(kan dosisdisp.)
Ferriprox |
453071 |
50 stk.
|
2.154,65 | 43,09 |
Substitution
| filmovertrukne tabletter 500 mg |
|---|
| Deferipron "Orifarm" Orifarm Generics, Deferipron, filmovertrukne tabletter 500 mg |
| filmovertrukne tabletter 1000 mg |
|---|
| Deferipron "Orifarm" Orifarm Generics, Deferipron, filmovertrukne tabletter 1000 mg |
Foto og identifikation
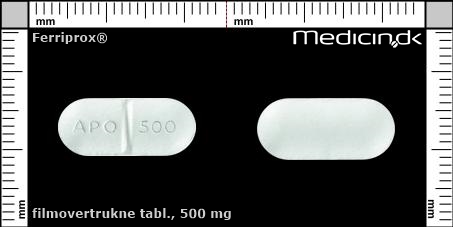
Filmovertrukne tabletter 500 mg |
| Præg: |
APO, 500
|
| Kærv: | Delekærv |
| Farve: | Hvid |
| Mål i mm: | 7,3 x 17,7 |
Filmovertrukne tabletter 1000 mg |
| Præg: |
APO, 1000
|
| Kærv: | Delekærv |
| Farve: | Hvid |
| Mål i mm: | 8,1 x 19,2 |

Der kan forekomme forskelle mellem lægemiddelbeskrivelsen og indlægssedlen eller det myndighedsgodkendte produktresumé. Det skyldes, at Medicin.dk kan have suppleret Lægemiddelstyrelsens og medicinvirksomhedernes information med andre kilder. Lægemiddelbeskrivelsen og anden information i Medicin.dk’s produkter er til generel vejledning og kan ikke erstatte professionel medicinsk rådgivning.
Konsulter altid en læge eller anden sundhedsprofessionel ved spørgsmål om medicin, dosering eller behandling.
Læs mere om Brugervilkår og ansvar .



