Yderligere information
Anvendelsesområder
- Generaliseret epilepsi som fx børneabsenceepilepsi, juvenil myoklon epilepsi. Kan også anvendes ved generaliserede krampeanfald og atone anfald (bl.a. myoklon astatisk epilepsi).
- Til forebyggelse af hyppige feberkramper og fotosensitiv epilepsi.
- Kan også have effekt ved fokale anfald, der spreder sig til bilaterale tonisk kloniske anfald. Se endvidere Epilepsi hos voksne.
- Intravenøs indgift anvendes ved status epilepticus, eller hvor oral indgift er umulig. Se endvidere Akutte anfald og status epilepticus.
- Manisk episode ved bipolar lidelse.
Andre anvendelsesområder
Dispenseringsform
Enterotabletter. 1 enterotablet indeholder 300 mg eller 600 mg valproat (som natriumsalt).
Orfiril® Retard, depottabletter. 1 depottablet (filmovertrukken) indeholder 300 mg valproat (som natriumsalt).
Orfiril® Long, depotkapsler, hårde. 1 depotkapsel indeholder 150 mg eller 300 mg valproat (som natriumsalt).
Orfiril® Long, depotgranulat i endosisbeholder. 1 endosisbeholder indeholder 500 mg eller 1.000 mg valproat (som natriumsalt).
Oral opløsning. 1 ml indeholder 60 mg valproat (som natriumsalt).
Doseringsforslag
Epilepsi
- Voksne. Initialt. 600 mg dgl. som enkeltdosis. Dosis øges til vedligeholdelsesdosis 600-1.200 mg dgl. fordelt på 1-2 doser.
- Børn. Vedligeholdelsesdosis. 20-30 mg/kg legemsvægt i døgnet, fordelt på 2 doser.
Mani
- Voksne. Individuelt. Den anbefalede initialdosis er 750 mg dgl. Derudover har en initialdosis på 20 mg/kg legemsvægt dgl. også vist en acceptabel sikkerhedsprofil i kliniske forsøg.
- Depotformuleringer kan gives en eller to gange dgl.
- Dosis skal øges så hurtigt, som det er muligt til den laveste terapeutiske dosis, der giver den ønskede kliniske effekt.
- Den daglige dosis skal tilpasses den kliniske respons for at fastlægge den laveste, effektive dosis til den enkelte patient. Vedligeholdelsesdosis ligger sædvanligvis på 1.000-2.000 mg dgl.
- Nøje monitorering af patienten ved doser over 45 mg/kg legemsvægt dgl.
Bemærk:
- Depotgranulat:
- Skal synkes helt.
- Kan evt. udrøres i mad eller drikke.
- Må ikke tygges eller knuses.
- Matriksen i depotgranulatet udskilles i tabletlignende form med fæces.
Håndtering af tabletter og kapsler
| enterotabletter 300 mg |
| enterotabletter 600 mg |
Administration
Synkes hele.
Mad og drikke
Tages med et glas vand.
Tages 1 time før et måltid..
| depottabletter 300 mg |
Administration
Synkes hele.
Mad og drikke
Tages med et glas vand.
Kan tages med eller uden mad.
Depottabletternes hårde kerne kan udskilles i tabletlignende form med afføringen.
OBS
Risikoen for bivirkninger i mave-tarm-kanalen kan nedsættes ved samtidig indtagelse af mad.
| hårde depotkapsler 150 mg |
| hårde depotkapsler 300 mg |
Knusning/åbning
Kan åbnes.
Administration
Synkes hele med et glas vand.
Indholdet kan opslæmmes i vand.
Må ikke tygges.
Mad og drikke
Kan tages med eller uden mad.
Indholdet kan kommes på blød mad, fx yoghurt eller æblemos.
Indtagelse sammen med mad nedsætter risikoen for bivirkninger i mave-tarm-kanalen.
OBS
Risikoen for bivirkninger i mave-tarm-kanalen kan nedsættes ved samtidig indtagelse af mad.
Oplysningerne kan muligvis afvige fra produktresumé. Se endvidere Håndtering af tabletter og kapsler .
forsigtighed, monitorering |
|
|---|---|
| GFR | Advarsel |
| <15 ml/min. |
Ved nedsat nyrefunktion kan det være nødvendigt at reducere dosis eller at øge dosis ved hæmodialyse, da valproat er dialyserbart. Dosering bør justeres i henhold til klinisk monitorering af patienten. |
Instruktioner og anden information
Kontraindikationer
- Leverlidelse, også nedsat leverfunktion hos nære slægtninge efter valproat- eller anden medikamentel behandling
- Trombocytopeni
- Hæmoragisk diatese
- Porfyri
- Defekter i urinstofcyklus
- Samtidig behandling med carbapenemer.
Forsigtighedsregler
Før behandling med valproat påbegyndes, undersøges
- hæmoglobin
- leukocytter
- trombocytter
- P-ASAT eller -ALAT
- P-basisk fosfatase
- P-bilirubin
- P-koagulationsfaktorer
- P-amylase
- P-kreatinin.
Analyserne gentages med passende mellemrum det første ½ år, fx efter 1, 3 og 6 måneder.
- Der skal være skærpet opmærksomhed på anvendelsen af valproat, hvis det bruges til behandling af et barn/en voksen, der debuterer med et epileptisk statusanfald som allerførste symptom.
- Det er vigtigt at instruere patient eller pårørende om initialsymptomerne ved toksisk hepatitis, som omfatter sløvhed, kvalme, opkastninger, diarré, abdominalsmerter eller evt. gulsot samt ophør af den kliniske effekt. Man bør i så fald straks henvende sig til den behandlende læge.
- Behandling med antiepileptika er forbundet med en let øget risiko for suicidaltanker eller -adfærd.
- Forsigtighed ved tidligere overfølsomhed over for andre antiepileptika, idet krydsreaktioner er beskrevet.
Risiko for hypocarnitinæmi
Valproat kan medføre fald i P-carnitin, der kan medføre hyperammoniæmi. Hypocarnitinæmi kan være alvorligt hos personer med visse genetiske metabolismeanomalier, som ses hyppigt hos færinger. Patienter bør instrueres at rapportere ethvert tegn på hyperammoniæmi, såsom ataksi, nedsat bevidsthed, opkastning. Carnitintilskud kan overvejes når symptomer på hypocarnitinæmi er valideret, baseret på kliniske fund og P-carnitin værdier.
Natriumindhold
- Enterotabletter: 1 enterotablet 300 mg eller 600 mg indeholder 1,8 mmol henholdsvis 3,6 mmol natrium, som svarer til ca. 105 mg henholdsvis ca. 210 mg natriumchlorid.
- Orfiril® Retard, depottabletter: 1 depottablet indeholder 1,8 mmol natrium, som svarer til ca. 105 mg natriumchlorid.
- Orfiril® Long, depotkapsler: 1 depotkapsel 150 mg eller 300 mg indeholder 1 mmol henholdsvis 1,8 mmol natrium, som svarer til ca. 59 mg henholdsvis ca. 105 mg natriumchlorid.
- Orfiril® Long, depotgranulat: 1 endosisbeholder 500 mg eller 1.000 mg indeholder 3 mmol henholdsvis 6 mmol natrium, som svarer til ca. 176 mg henholdsvis ca. 352 mg natriumchlorid.
- Oral opløsning: 5 ml indeholder 1,8 mmol natrium, som svarer til ca. 105 mg natriumchlorid.
Bivirkninger
Valproats sikkerhedsprofil hos den pædiatriske population er sammenlignelig med den hos voksne, men nogle bivirkninger er alvorligere eller ses hovedsageligt hos den pædiatriske population. Der er en særlig risiko for svær leverskade hos spædbørn og små børn, især børn under 3 år. Små børn har også en særlig risiko for pancreatitis. Disse risici falder med stigende alder. Hos børn i alderen 2-10 år er valproat-clearance 50 % højere end hos voksne.
Psykiske forstyrrelser som aggression, agitation, opmærksomhedsforstyrrelser, unormal adfærd, psykomotorisk hyperaktivitet og indlæringsvanskeligheder ses hovedsageligt hos den pædiatriske population.
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Kvalme | |
| Nervesystemet | Tremor | |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Anæmi, Hæmoragi, Knoglemarvsdepression, Trombocytopeni | |
| Øre og labyrint | Høretab | |
| Øjne | Nystagmus | |
| Mave-tarm-kanalen | Diarré, Dyspepsi, Opkastning | |
| Lever og galdeveje | Hepatotoksicitet | |
| Undersøgelser | Vægtændring | |
| Metabolisme og ernæring | Hyponatriæmi | Nedsat eller øget appetit |
| Knogler, led, muskler og bindevæv | Kramper | |
| Nervesystemet | Bevidsthedstab, Ekstrapyramidale gener, Hukommelsesbesvær, Svimmelhed | Hovedpine |
| Psykiske forstyrrelser | Aggressivitet, Agitation, Hallucinationer, Koncentrationsbesvær, Konfusion, Somnolens | Døsighed |
| Det reproduktive system og mammae | Dysmenoré | |
| Hud og subkutane væv | Alopeci | Allergiske hudreaktioner, Negleforandringer |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Pancytopeni | |
| Det endokrine system | Schwartz-Bartters syndrom | |
| Mave-tarm-kanalen | Pancreatitis | Øget spytsekretion |
| Almene symptomer og reaktioner på administrationsstedet | Hypotermi**, Letargi | |
| Lever og galdeveje | Leverpåvirkning | |
| Immunsystemet | Angioødem | |
| Traumer, forgiftninger og behandlingskomplikationer | Fraktur* | |
| Knogler, led, muskler og bindevæv | Osteoporose* | |
| Nervesystemet | Ataksi, Encefalopati, Koma, Parkinsonisme, Paræstesier | |
| Psykiske forstyrrelser | Hyperaktivitet | Irritabilitet |
| Nyrer og urinveje | Nyresvigt | |
| Det reproduktive system og mammae | Amenoré | |
| Luftveje, thorax og mediastinum | Pleuraekssudat | |
| Hud og subkutane væv | Hududslæt | |
| Vaskulære sygdomme | Perifere ødemer, Vasculitis | |
| Sjældne (0,01-0,1 %) | ||
| Blod og lymfesystem | Agranulocytose, Erytrocytaplasi, Myelodysplastisk syndrom | |
| Det endokrine system | Hypotyroidisme | |
| Øjne | Dobbeltsyn | |
| Immunsystemet | Stevens-Johnsons syndrom | |
| Metabolisme og ernæring | Porfyri | Hyperammonæmi |
| Knogler, led, muskler og bindevæv | Rhabdomyolyse, Systemisk lupus erythematosus (SLE) | |
| Benigne, maligne og uspecificerede neoplasmer | Ovariecyster | |
| Psykiske forstyrrelser | Kognitiv dysfunktion | Enuresis nocturna |
| Nyrer og urinveje | Fanconis syndrom, Interstitiel nefritis | |
| Det reproduktive system og mammae | Infertilitet (mandlig) | |
| Hud og subkutane væv | Erythema multiforme, Lægemiddelreaktion med eosinofili og systemiske symptomer - DRESS, Toksisk epidermal nekrolyse (TEN) | |
| Vaskulære sygdomme | Kutan vasculitis | |
| Meget sjældne (< 0,01 %) | ||
| Øre og labyrint | Tinnitus | |
| Mave-tarm-kanalen | Gingival hyperplasi, Stomatitis | |
| Ikke kendt hyppighed | ||
| Blod og lymfesystem | Lymfocytose | |
| Metabolisme og ernæring | Metabolisk syndrom*** | |
| Nyrer og urinveje | Inkontinens | |
| Hud og subkutane væv | Hyperpigmentering | |
* Langtidsbehandling er forbundet med risiko for nedsat knoglemineraltæthed, osteopeni, osteoporose og knoglebrud.
** Ved kombinationsbehandling med topiramat og valproat er set hypotermi med kernetemperatur < 35 °C.
*** Hos personer med medfødt gen-defekt i forbrændingen af fedt ((Carnitin transporter defekt, CTD).
Erhvervet Pelger-Huet anomali er rapporteret i tilfælde med og uden myelodysplastisk syndrom.
Interaktioner
- Valproat hæmmer eliminationen af phenobarbital, primidon og lamotrigin formentlig ved enzymhæmning, hvorved plasmakoncentrationen af phenobarbital eller lamotrigin stiger, og den sedative virkning af phenobarbital og effekten af lamotrigin øges.
- Valproat nedsætter omsætningen af ethosuximid, hvorved effekten og risikoen for bivirkninger øges.
- Valproat kan øge plasmakoncentrationen af rufinamid, og dosis af rufinamid bør derfor reduceres ved legemsvægt < 30 kg.
- Valproat kan nedsætte koncentrationen af olanzapin med op til 32 %.
- Phenobarbital, primidon og rifampicin øger eliminationen af valproat.
- Doxorubicin nedsætter absorptionsfraktionen og dermed plasmakoncentrationen af valproat.
- Carbapenemer kan nedsætte plasmakoncentrationen af valproat med 60-100 % i løbet af ca. 2 dage, og kombinationen bør derfor undgås.
- Østrogener kan øge clearance af valproat ved induktion af UDP-glucuronosyltransferaser (UGT), hvilket kan resultere i nedsat serumkoncentration af valproat og potentielt nedsat effekt. Monitorering af P-valproat ved initiering eller ophør med østrogenholdige midler, herunder hormonel antikonception, bør overvejes.
- Samtidig behandling med cisplatin øger risikoen for knoglemarvsdepression. Kombinationen bør undgås.
- Phenytoin og valproat konkurrerer om samme bindingssted på plasma-albumin. På grund af valproats højere affinitet fortrænges phenytoin delvis. Dette medfører en øget fri fraktion af phenytoin, som sekundært kan bevirke en øget metabolisering med deraf følgende lavere totalkoncentration. På trods af den lavere totalkoncentration reduceres den kliniske virkning næppe, fordi den frie fraktion til gengæld forøges. Phenytoindosis skal derfor ikke øges. I nogle tilfælde har man iagttaget en hæmning af phenytoins metabolisme med intoksikation til følge. I praksis er resultaterne mindre klare. Da måling af plasmakoncentrationer i dette tilfælde ikke kan afklare problemet på grund af uforudsigeligheden af den frie fraktion, bør de 2 stoffer kun med forsigtighed bruges sammen.
- Samtidig brug af salicylater bør undgås hos børn under 3 år på grund af risikoen for hepatotoksicitet.
- Samtidig brug af cannabidiol kan medføre øgning af ALAT > 3 gange normalværdien.
- Enkelte rapporter beskriver et signifikant fald i serumniveauer af valproat efter administration af methotrexat med forekomst af anfald. Klinisk respons bør monitoreres (anfalds-/stemningskontrol) og dosisjustering overvejes.
- Samtidig anvendelse med pivalatkonjugerende midler (fx pivmecillinam) kan øge risiko for carnitindepletion (carnitinmangel). Hvis samtidig administration ikke kan undgås, monitorering for symptomer på carnitinmangel kan overvejes.
- Ved samtidig administration af topiramat eller acetazolamid er der registreret tilfælde af hyperammoniæmi med /uden encefalopati og monitorering for symptomer på hyperammoniæmisk encefalopati anbefales.
- Samtidig behandling med clozapin kan øge risikoen for neutropeni og clozapin induceret myocarditis. Hvis samtidig behandling er nødvendig, monitorering for neutropeni og myocarditis anbefales.
Se endvidere Epilepsi hos voksne.
Graviditet
Baggrund: Behandling med valproat under graviditet er som udgangspunkt kontraindiceret.
Må kun anvendes på indikationen behandlingsrefraktær epilepsi, hvor anden behandling er utilstrækkelig, og valproat skønnes absolut nødvendigt og kun i samarbejde med en speciallæge i neurologi.
Ved anvendelse bør der gives folsyre 5 mg dgl. EMA’s bivirkningskomité, PRAC, fraråder anvendelsen af valproat til kvinder i den fødedygtige alder på nedenstående baggrund:
Der er data for mere end 3.000 1. trimester-eksponerede (nogle datasæt overlapper dog en del og det præcise tal er ikke veldefineret) med en hyppighed af medfødte misdannelser på 8-10 %. Der synes at være en ret klar dosisafhængighed, idet risikoen stiger betydeligt ved doser over 1.000 mg dgl. Valproat er forbundet med risiko for medfødte neuralrørsdefekter på ca. 1,5 %. Det føtale valproatsyndrom er et fænotypisk syndrom, som er karakteriseret af forskellige kombinationer af neuralrørsdefekter, kraniofaciale-, øjen-, kardielle- og urogenitale misdannelser samt ekstremitetsmisdannelser. Alvorlig ototoksicitet er også meddelt.
Behandlingen af epilepsi hos gravide skal altid varetages i samarbejde med en speciallæge i neurologi.
Se endvidere Epilepsi hos voksne.
Se også: Klassifikation - graviditet
Fertile kvinder og mænd
Der skal foreligge negativ graviditetstest inden initiering af behandling og anvendes sikker kontraception under en eventuel behandling.
Produktresumeet angiver ”…tyder på en øget risiko for neurologiske udviklingsforstyrrelser hos børn af mænd behandlet med valproat i de 3 måneder inden befrugtning sammenlignet med børn af mænd behandlet med lamotrigin eller levetiracetam”. Dette er baseret på et meget omdiskuteret observationelt (ikke publiceret) studie baseret på data fra Danmark, Norge og Sverige. Et nyere publiceret analogt studie alene baseret på danske data kunne ikke genfinde dette.
Amning
Baggrund: Den relative vægtjusterede dosis er under 1 %. Der er ikke beskrevet bivirkninger hos barnet.
Trafik
Bloddonor
Doping

|
Ingen restriktioner |
Alkohol
Alkohol bør undgås ved behandling med Orfiril®, da det forstærker virkningen af alkohol.
Forgiftning
Farmakodynamik
Virkemåden er ikke endeligt afklaret, men hænger muligvis sammen med øget mængde GABA i hjernen og hæmning af natriumkanaler.
Farmakokinetik
- Plasmahalveringstid 9-16 timer, hos børn dog ofte kortere.
- Metaboliseres til over 20 forskellige metabolitter, hvoraf nogle anses for at være hepatotoksiske.
- < 5 % udskilles uomdannet gennem nyrerne.
- Se endvidere Tabel 1 i Antiepileptika.
- Depottabletterne (monodepot) og depotkapslerne (polydepot) frigiver det aktive stof over flere timer. Maksimal plasmakoncentration efter 1-2 timer (oral opløsning), 3-5 timer (enterotabletter og depotkapsler) og 5-10 timer (depottabletter og depotgranulat).
Indholds- og hjælpestoffer
Valproat .
| Lægemiddelform | Styrke | Indholdsstoffer | Hjælpestoffer |
|---|---|---|---|
| depotgranulat | 500 mg |
Konservering
Andre
|
|
| 1000 mg |
Konservering
Andre
|
||
| depottabletter | 300 mg |
Farve
Andre
|
|
| enterotabletter | 300 mg |
Farve
Andre
|
|
| 600 mg |
Farve
Andre
|
||
| hårde depotkapsler | 150 mg |
Konservering
Farve
Andre
|
|
| 300 mg |
Konservering
Farve
Andre
|
||
| oral opløsning | 60 mg/ml |
Konservering
Farve
Smag
Andre
|
|
| 60 mg/ml (Medartuum) |
Konservering
Farve
Smag
Andre
|
Firma
Tilskud
Orfiril® Retard, depottabletter:
Klausuleret tilskud til:
- Velbehandlede patienter med epilepsi, hvor det efter lægens samlede kliniske vurdering af patienten vil være uhensigtsmæssigt med et præparatskifte til et lægemiddel med indhold af valproinsyre med generelt tilskud uden klausulering.
For de patienter, der opfylder klausulen, påtegnes recepten med ordet "tilskud".
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | enterotabletter
300 mg
(kan dosisdisp.)
Orfiril |
051110 |
100 stk.
|
203,10 | 2,03 | 10,16 | |
| (B) | enterotabletter
600 mg
(kan dosisdisp.)
Orfiril |
526798 |
100 stk.
|
376,65 | 3,77 | 9,42 | |
| (B) | depottabletter
300 mg
(kan dosisdisp.)
Orfiril Retard |
526376 |
100 stk.
|
2.320,45 | 23,20 | 116,02 | |
| (B) | hårde depotkapsler
150 mg
(kan dosisdisp.)
Orfiril Long |
045583 |
100 stk.
|
149,75 | 1,50 | 14,98 | |
| (B) | hårde depotkapsler
300 mg
(kan dosisdisp.)
Orfiril Long |
046797 |
100 stk.
|
215,30 | 2,15 | 10,77 | |
| (B) | depotgranulat
500 mg
Orfiril Long |
128454 |
100 stk. (blister)
|
277,05 | 2,77 | 8,31 | |
| (B) | depotgranulat
1000 mg
Orfiril Long |
128983 |
100 stk. (blister)
|
533,35 | 5,33 | 8,00 | |
| (B) | oral opløsning
60 mg/ml
Orfiril |
188631 |
250 ml
|
377,95 | 1,51 | 37,80 | |
| (B) | oral opløsning
60 mg/ml
(Medartuum)
Orfiril |
393434 |
250 ml
|
475,70 | 1,90 | 47,57 |
Foto og identifikation
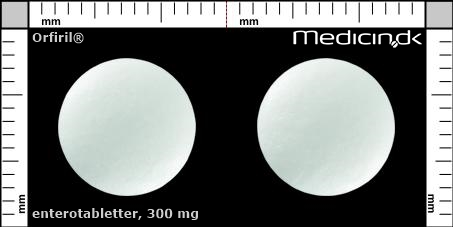
Enterotabletter 300 mg |
| Præg: |
Intet præg
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 10,4 x 10,4 |
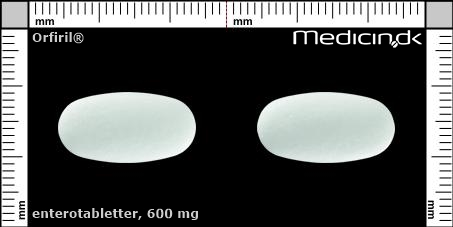
Enterotabletter 600 mg |
| Præg: |
Intet præg
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 10 x 19,5 |
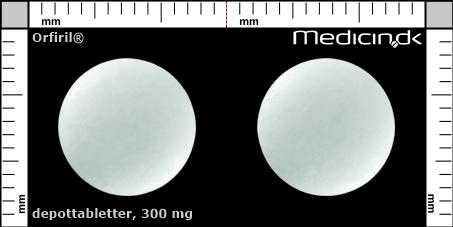
Depottabletter 300 mg |
| Præg: |
Intet præg
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 10,4 x 10,4 |
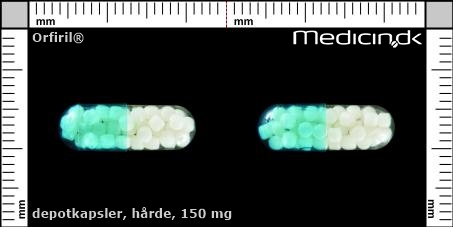
Hårde depotkapsler 150 mg |
| Præg: |
Intet præg
|
| Kærv: | Ikke relevant |
| Farve: | Gennemsigtig, Blå |
| Mål i mm: | 6,2 x 17,5 |
Hårde depotkapsler 300 mg |
| Præg: |
Intet præg
|
| Kærv: | Ikke relevant |
| Farve: | Gennemsigtig, Grøn |
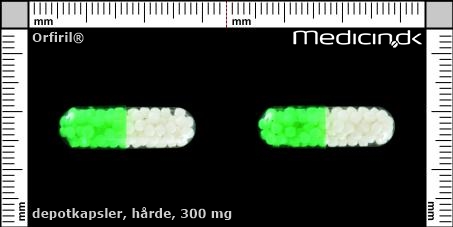
| Mål i mm: | 7,3 x 23,8 |
Referencer
6256. Christensen J, Trabjerg BB, Dreier JW. Valproate Use During Spermatogenesis and Risk to Offspring. JAMA Netw Open. 2024; 7(6), https://pubmed.ncbi.nlm.nih.gov/38833248/ (Lokaliseret 10. juli 2024)
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
4138. Tomson T, Battino D, Bonizzoni E et al. Comparative risk of major congenital malformations with eight different antiepileptic drugs: a prospective cohort study of the EURAP registry. Lancet Neurol. 2018; 17(6):530-8, https://www.ncbi.nlm.nih.gov/pubmed/29680205 (Lokaliseret 24. februar 2022)
4141. Petersen I, Collings SL, McCrea RL et al. Antiepileptic drugs prescribed in pregnancy and prevalence of major congenital malformations: comparative prevalence studies. Clin Epidemiol. 2017; 9:95-103, https://www.ncbi.nlm.nih.gov/pubmed/28243149 (Lokaliseret 24. februar 2022)
4142. Weston J, Bromley R, Jackson CF et al. Monotherapy treatment of epilepsy in pregnancy: congenital malformation outcomes in the child. Cochrane Database Syst Rev. 2016; 11, https://www.ncbi.nlm.nih.gov/pubmed/27819746 (Lokaliseret 24. februar 2022)
4221. Tomson T, Battino D, Bonizzoni E et al. Dose-dependent teratogenicity of valproate in mono- and polytherapy: an observational study. Neurology. 2015; 85:866-72, https://www.ncbi.nlm.nih.gov/pubmed/26085607 (Lokaliseret 24. februar 2022)
3835. Källén B, Borg N, Reis M. The use of central nervous system active drugs during pregnancy. Pharmaceuticals (Basel). 2013; 6(10):1221-86, https://www.ncbi.nlm.nih.gov/pubmed/24275849 (Lokaliseret 24. februar 2022)
Der kan forekomme forskelle mellem lægemiddelbeskrivelsen og indlægssedlen eller det myndighedsgodkendte produktresumé. Det skyldes, at Medicin.dk kan have suppleret Lægemiddelstyrelsens og medicinvirksomhedernes information med andre kilder. Lægemiddelbeskrivelsen og anden information i Medicin.dk’s produkter er til generel vejledning og kan ikke erstatte professionel medicinsk rådgivning.
Konsulter altid en læge eller anden sundhedsprofessionel ved spørgsmål om medicin, dosering eller behandling.
Læs mere om Brugervilkår og ansvar .



