Yderligere information
Antiviralt middel mod HIV og HBV. Hæmmer det HIV-specifikke enzym reverse transcriptase. Hæmmer HBV-replikation.
Anvendelsesområder
- HIV
Anvendes i kombination med andre antiretrovirale lægemidler til behandling af HIV-infiktion. Se endvidere kombinationsbehandling i Midler mod HIV. - Hepatitis B
Kronisk hepatitis B med tegn på betydende virusreplikation eller vedvarende forhøjede serumtransaminaser med tegn på inflammation eller fibrose/cirrhose. Der bruges monobehandling.
Bør kun anvendes, når behandlingen forestås af læger med særlig indsigt i behandling af HIV eller kronisk hepatitis B.
Dispenseringsform
Tabletter. 1 tablet (filmovertrukken) indeholder 245 mg tenofovirdisoproxil (som succinat).
Doseringsforslag
Voksne og børn ≥ 12 år med legemsvægt ≥ 35 kg
- 245 mg 1 gang dgl.
- Før behandling bør serum-ALAT være vedvarende forhøjet i:
- mindst 6 mdr. hos børn med kompenseret leversygdom, der skyldes HBeAg-positiv kronisk hepatitis B
- mindst 12 mdr. hos børn med HBeAg-negativ sygdom.
Til børn 2-12 år findes andet præparat, som granulat og tabletter med lavere styrke.
Bemærk:
- Ved opkastning < 1 time efter indtagelse, tages en ny dosis.
- Glemt dosis kan tages til et måltid indtil 12 timer før næste dosis.
Håndtering af tabletter og kapsler
| filmovertrukne tabletter 245 mg |
Knusning/åbning
Kan knuses.
Bemærk: Knusning kan nedsætte/øge virkningen af tabletterne, og derfor er ekstra kontrol nødvendigt.
Administration
Knust tablet kan opslæmmes i vand, appelsinjuice eller druesaft.
Mad og drikke
Tages med et glas vand.
Tages med mad.
Knust tablet kan kommes på kold, blød mad.
Oplysningerne kan muligvis afvige fra produktresumé. Se endvidere Håndtering af tabletter og kapsler .
forsigtighed, dosisjustering |
|||
|---|---|---|---|
| GFR | Alder | Vægt | Advarsel |
| <10 ml/min. | ≥12 år | ≥35 KG |
Ingen dosisanbefalinger til ikke-hæmodialyse-patienter. Hæmodialyse: 16,5 mg dgl. eller 245 mg 1 gang om ugen. Stor forsigtighed og tæt monitorering. |
| 10-20 ml/min. | ≥12 år | ≥35 KG |
Højst 33 mg dgl. eller 245 mg 2 gange om ugen. |
| 20-30 ml/min. | ≥12 år | ≥35 KG |
Højst 65 mg dgl. eller 245 mg 2 gange om ugen. |
| 30-50 ml/min. | ≥12 år | ≥35 KG |
Højst 132 mg dgl. eller 245 mg hver 2. dag. |
Forsigtighedsregler
- Nyrefunktionen (eGFR og serum-fosfat) bør kontrolleres før behandlingsstart og derefter regelmæssigt:
- Hos patienter uden renale risikofaktorer:
- efter 2-4 ugers behandling
- efter 3 måneders behandling
- derefter hver 3.-6. måned.
- Hos patienter med risiko for nedsat nyrefunktion:
- hyppigere kontrol er nødvendig.
- Hos patienter uden renale risikofaktorer:
- Ved forværring af nyrefunktionen uden anden påviselig forklaring bør seponering af tenofovir overvejes.
- Bør ikke anvendes samtidig med nefrotoksiske lægemidler, men hvis dette ikke kan undgås, skal nyrefunktionen kontrolleres mindst én gang om ugen.
- Nyrefunktionen skal kontrolleres tæt ved samtidig behandling med højdosis NSAID eller ritonavir/cobicistat boosted HIV-proteasehæmmer.
- Anden behandling bør overvejes til patienter med osteoporose med høj risiko for frakturer.
- Tenofovirdisoproxil kan forårsage et fald i knoglemineraltæthed (BMD); men indvirkning på fremtidig frakturrisiko er uvis.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Diarré, Kvalme, Opkastning | |
| Almene symptomer og reaktioner på administrationsstedet | Kraftesløshed | |
| Metabolisme og ernæring | Hypofosfatæmi | |
| Nervesystemet | Svimmelhed | |
| Hud og subkutane væv | Hududslæt | |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Flatulens, Meteorisme |
| Almene symptomer og reaktioner på administrationsstedet | Træthed | |
| Undersøgelser | Fald i knoglemineraltætheden, Forhøjede levertransaminaser | |
| Nervesystemet | Hovedpine | |
| Ikke almindelige (0,1-1 %) | ||
| Mave-tarm-kanalen | Pancreatitis | |
| Undersøgelser | Forhøjet plasma-kreatinin | |
| Metabolisme og ernæring | Hypokaliæmi | |
| Knogler, led, muskler og bindevæv | Muskelsvaghed, Rhabdomyolyse | |
| Nyrer og urinveje | Proksimal renal tubulopati (herunder Fanconis syndrom) | |
| Sjældne (0,01-0,1 %) | ||
| Lever og galdeveje | Hepatitis | |
| Immunsystemet | Angioødem | |
| Metabolisme og ernæring | Lactatacidose* | |
| Knogler, led, muskler og bindevæv | Myopati, Osteomalaci | |
| Nyrer og urinveje | Akut nyresvigt, Nefritis (herunder akut interstitiel nefritis), Nefrogen diabetes insipidus, Nyresvigt, Renal tubulær nekrose | |
* Laktatacidose er rapporteret ved behandling med tenofovirdisoproxil alene eller i kombination andre antiretrovirale lægemidler. Ved prædisponerende faktorer, fx dekompenseret leversygdom, eller ved samtidig brug af laktatacidose-inducerende lægemidler er der større risiko for svær laktatacidose, herunder med letal udgang.
Kliniske aspekter
- HIV 1 og hepatitis B: Hos patienter, der behandles med tenoforvirdisoproxil, er der rapporteret sjældne tilfælde af nedsat nyrefunktion, nyresvigt og ikke almindeligt forekommende hændelser af proksimal renal tubulopati (herunder Fanconis syndrom), som nogle gange kan medføre knogleabnormiteter (i sjældne tilfælde er det rapporteret som medvirkende årsag til frakturer).
- Nyrefunktionen bør monitoreres hos patienter, som får Tenofovirdisoproxil.
- Laktatacidose er rapporteret ved behandling med tenofovirdisoproxil alene eller i kombination andre antiretrovirale lægemidler. Ved prædisponerende faktorer, fx dekompenseret leversygdom, eller ved samtidig brug af laktatacidose-inducerende lægemidler er der større risiko for svær laktatacidose, herunder med letal udgang.
Interaktioner
- Hos patienter med risikofaktorer for renal dysfunktion, som samtidig er i højdosisbehandling med NSAID, er set tilfælde af nyresvigt. Tæt monitorering af nyrefunktionen er derfor påkrævet.
- Ved samtidig brug af sofosbuvir/ledipasvir/velpatasvir sammen med tenofovir (specielt sammen med en farmakokinetisk booster) skal der udvises forsigtighed med hyppig monitorering af nyrefunktionen, idet koncentrationen af tenofovir øges.
- Bør ikke anvendes samtidig med andre lægemidler, der indeholder tenofovirdisoproxil, tenofoviralafenamid eller adefovirdipivoxil.
Graviditet
Baggrund: Store epidemiologiske studier viser samstemmende, at antiretroviral behandling under graviditeten (for alle lægemidler og kombinationer er der data for i alt > 35.000 gravide; heraf > 16.000 eksponeret i 1. trimester) ikke er forbundet med en overhyppighed af medfødte misdannelser. Visse studier viser en lidt øget risiko for tidlig fødsel og lav fødselsvægt, men det er uklart, om og i hvilket omfang dette kan tilskrives behandlingen.
For tenofovirdisoproxil er der data for mere end 3.200 1. trimester-eksponerede uden tegn på overhyppighed af uønsket fosterpåvirkning.
Behandling af gravide med HIV-infektion er en specialistopgave. Se endvidere Midler mod HIV.
Se også: Klassifikation - graviditet
Amning
Behandling af HIV:
Må ikke anvendes.
Baggrund: Amning frarådes på grund af smitterisiko.
Behandling af hepatitis B:
Kan om nødvendigt anvendes.
Baggrund: Udskilles i minimale mængder i modermælken, og eksponering gennem amning skønnes uden betydning
Bloddonor
Doping

|
Ingen restriktioner |
Alkohol
Forsigtighed ved indtagelse af alkohol under behandling med Tenofovir disoproxil "Stada".
Alkoholforbrug kan bidrage til tilfælde af osteonekrose.
Farmakodynamik
- HIV-nukleotid-RT-hæmmer.
- Omdannes intracellulært til den aktive metabolit.
- Nukleosid- og nukleotidanalog mod hepatitis B virus.
Farmakokinetik
- Tenofovirdisoproxil er en prodrug, som hurtigt omdannes til den aktive substans tenofovir.
- Biotilgængelighed ca. 25 %. Øges med ca. 40 % ved samtidig indtagelse af fedtrigt måltid.
- Maksimal plasmakoncentration efter 1-2 timer.
- Terminal plasmahalveringstid 12-18 timer.
- 70-80 % udskilles gennem nyrerne som tenofovir.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 245 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | filmovertrukne tabletter
245 mg
(kan dosisdisp.)
Tenofovir disoproxil "Stada" |
095495 |
30 stk.
|
397,35 | 13,25 | 13,25 |
Substitution
| filmovertrukne tabletter 245 mg |
|---|
| Tenofovir disopr. Accordpharma Accord, Tenofovirdisoproxil, filmovertrukne tabletter 245 mg |
| Tenofovir disoproxil "Glenmark Glenmark Nordic, Tenofovirdisoproxil, filmovertrukne tabletter 245 mg |
| Tenofovir disoproxil "Teva" TEVA, Tenofovirdisoproxil, filmovertrukne tabletter 245 mg |
| Tenofovir disoproxil "Zentiva" Zentiva, Tenofovirdisoproxil, filmovertrukne tabletter 245 mg |
| Viread Gilead Sciences, Tenofovirdisoproxil, filmovertrukne tabletter 245 mg |
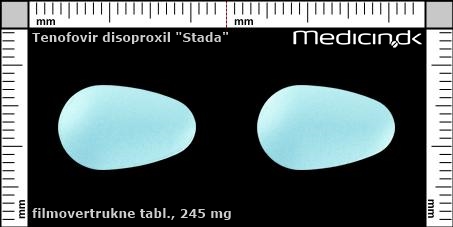
Foto og identifikation
Filmovertrukne tabletter 245 mg |
| Præg: |
Intet præg
|
| Kærv: | Ingen kærv |
| Farve: | Lyseblå |
| Mål i mm: | 10,5 x 17 |
Referencer
4375. Gandhi RT, Bedimo R, Hoy JF et al. Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults: 2022 Recommendations of the International Antiviral Society-USA Panel. JAMA. 2023; 329-(1):63-84, https://pubmed.ncbi.nlm.nih.gov/33052386/ (Lokaliseret 24. juli 2023)
4376. European Pregnancy and Paediatric HIV Cohort Collaboration (EPPICC) Study Group. Nucleoside reverse transcriptase inhibitor backbones and pregnancy outcomes. AIDS. 2019; 33(2):295-304, https://www.ncbi.nlm.nih.gov/pubmed/30562172 (Lokaliseret 3. marts 2022)
4377. Veroniki AA, Antony J, Straus SE et al. Comparative safety and effectiveness of perinatal antiretroviral therapies for HIV-infected women and their children: Systematic review and network meta-analysis including different study designs. PLoS One. 2018; 13(6), https://www.ncbi.nlm.nih.gov/pubmed/29912896 (Lokaliseret 3. marts 2022)
4379. Rough K, Seage GR 3rd, Williams PL et al. Birth Outcomes for Pregnant Women with HIV Using Tenofovir-Emtricitabine. N Engl J Med. 2018; 378(17):1593-603, https://www.ncbi.nlm.nih.gov/pubmed/29694825 (Lokaliseret 3. marts 2022)
4378. Zash R, Jacobson DL, Diseko M et al. Comparative Safety of Antiretroviral Treatment Regimens in Pregnancy. JAMA Pediatr. 2017; 171(10), https://www.ncbi.nlm.nih.gov/pubmed/28783807 (Lokaliseret 3. marts 2022)
4374. Antiretroviral Pregnancy Registry Advisory Committee. Interim Report. ANTIRETROVIRAL PREGNANCY REGISTRY. 1989-2023, http://www.apregistry.com/InterimReport.aspx (Lokaliseret 24. juli 2023)
Der kan forekomme forskelle mellem lægemiddelbeskrivelsen og indlægssedlen eller det myndighedsgodkendte produktresumé. Det skyldes, at Medicin.dk kan have suppleret Lægemiddelstyrelsens og medicinvirksomhedernes information med andre kilder. Lægemiddelbeskrivelsen og anden information i Medicin.dk’s produkter er til generel vejledning og kan ikke erstatte professionel medicinsk rådgivning.
Konsulter altid en læge eller anden sundhedsprofessionel ved spørgsmål om medicin, dosering eller behandling.
Læs mere om Brugervilkår og ansvar .



