Middel med specifik antiinflammatorisk virkning på bindevæv i tarmvæggen.
Anvendelsesområder
- Colitis ulcerosa
- Morbus Crohn.
Dispenseringsform
Depottabletter. 1 depottablet indeholder 500 mg mesalazin.
Doseringsforslag
Colitis ulcerosa
Oralt
- Voksne
- Initialt op til 4.000 mg dgl.
- Vedligeholdelsesdosis 1.500-3.000 mg i døgnet.
- Kan indtages i delte doser eller som éngangsdøgndosis.
Morbus crohn
Oralt
- Voksne
- Initialt op til 4.500 mg dgl.
- Vedligeholdelsesdosis op til 4.500 mg i døgnet.
- Kan indtages i delte doser eller som éngangsdøgndosis.
Børn > 6 år med Morbus crohn eller Colitis ulcerosa
- Initialt 30-50 mg/kg legemsvægt i døgnet fordelt på flere doser.
- Maksimal dosis. 75 mg/kg/dag i opdelte doser.
- Den totale dosis bør ikke overstige 4.000 mg i døgnet.
- Vedligeholdelsesdosis 15-30 mg/kg legemsvægt i døgnet fordelt på flere doser.
- Den totale dosis bør ikke overstige 2.000 mg i døgnet.
Bemærk:
Erfaring savnes vedr. børn < 6 år.
Håndtering af tabletter og kapsler
| depottabletter 500 mg (2care4) |
Knusning/åbning
Må ikke knuses.
Administration
Kan synkes hele eller halve.
Tablet kan opslæmmes i vand eller æblejuice.
Må ikke tygges.
Mad og drikke
Tages med et glas vand.
Oplysningerne kan muligvis afvige fra produktresumé. Se endvidere Håndtering af tabletter og kapsler .
kontraindiceret, øget bivirkningsrisiko |
|
|---|---|
| GFR | Advarsel |
| <30 ml/min. |
Risiko for mesalazininduceret nyreskade. |
Nedsat leverfunktion
Kontraindikationer
- Allergi over for mesalazin-derivater.
Forsigtighedsregler
- Der er rapporteret udvikling af reversibel interstitiel nefritis under behandling. Nyrefunktionen foreslås monitoreret efter 6 ugers, 6 måneders og 12 måneders behandling og derefter én gang årligt.
- Forsigtighed bør udvises ved nedsat leverfunktion. Blodprøver bør tages før initiering af behandlingen samt 14 dage senere samt derefter yderligere 2-3 gange med 4 ugers interval. Hvis prøverne er normale, tages der blodprøver hver 3. måned.
- Ved mistanke om bloddyskrasi skal mesalazin straks seponeres. Blodprøver bør tages før initiering af behandlingen samt 14 dage senere samt derefter yderligere 2-3 gange med 4 ugers interval. Hvis prøverne er normale, tages blodprøver hver 3. måned.
- Patienter med kronisk nedsat lungefunktion, særligt astma, har risiko for overfølsomhedsreaktioner.
- Forsigtighed ved aktivt gastro-duodenale ulcera.
- Forsigtighed ved svær overfølsomhedsreaktion på NSAID inkl. acetylsalicylsyre, selvom risikoen for krydsallergi anses for lav.
- Mesalazin er blevet sat i forbindelse med et akut intoleranssyndrom, som kan være svært at skelne fra en opblussen i inflammatorisk tarmsygdom.
- Der er rapporteret om alvorlige kutane bivirkninger, og mesalazin bør seponeres ved de første tegn og symptomer på alvorlige hudreaktioner, fx hududslæt, slimhindelæsioner eller andre tegn på overfølsomhed.
- Idiopatisk intrakraniel hypertension (pseudotumor cerebri) er rapporteret ved brug af mesalazin. Patienter bør informeres om symptomer som svær eller tilbagevendende hovedpine, synsforstyrrelser eller tinnitus. Hvis der opstår idiopatisk intrakraniel hypertension, bør seponering af mesalazin overvejes.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Almindelige (1-10 %) | ||
| Hud og subkutane væv | Hudkløe | |
| Sjældne (0,01-0,1 %) | ||
| Hjerte | Myocarditis, Pericarditis | |
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Flatulens, Kvalme, Opkastning |
| Nervesystemet | Svimmelhed | Hovedpine |
| Hud og subkutane væv | Fotosensibilitet* | |
| Meget sjældne (< 0,01 %) | ||
| Blod og lymfesystem | Agranulocytose, Aplastisk anæmi, Leukopeni, Neutropeni, Pancytopeni, Trombocytopeni | |
| Mave-tarm-kanalen | Colitis (forværring), Pancreatitis | |
| Almene symptomer og reaktioner på administrationsstedet | Drug fever | |
| Lever og galdeveje | Hepatitis, Hepatotoksicitet, Leverpåvirkning (forhøjede transaminaser og kolestatiske parametre) | |
| Immunsystemet | Hypersensitivitetsreaktioner | |
| Knogler, led, muskler og bindevæv | Artralgi, Subakut kutan lupus erythematosus | Myalgi |
| Nervesystemet | Perifer neuropati | |
| Nyrer og urinveje | Interstitiel nefritis, Nefrotisk syndrom, Nyresvigt | |
| Det reproduktive system og mammae | Oligospermi (reversibel) | |
| Luftveje, thorax og mediastinum | Allergiske lungereaktioner (inkl. dyspnø, hoste, bronkospasme, alveolitis, pulmonal eosinofil, lungeinfiltrater, pneumoni) | |
| Hud og subkutane væv | Alopeci, Erythema multiforme | |
| Ikke kendt hyppighed | ||
| Immunsystemet | Stevens-Johnsons syndrom | |
| Nyrer og urinveje | Nyresten | |
| Hud og subkutane væv | Lægemiddelreaktion med eosinofili og systemiske symptomer - DRESS, Toksisk epidermal nekrolyse (TEN) | |
* Der er rapporteret svære reaktioner hos patienter med præeksisterende hudlidelser, fx atopisk dermatitis.
Idiopatisk intrakraniel hypertension er rapporteret, med ukendt hyppighed.
Interaktioner
Samtidig behandling med azathioprin eller mercaptopurin kan øge risikoen for knoglemarvsdepression. Monitorering af blodtal og dosisjustering af mercaptopurin bør overvejes.
Graviditet
Baggrund: For oral og rektal administration af mesalazin er der i alt data for mere end 3.000 1. trimester-eksponerede uden tegn på overhyppighed af uønsket fosterpåvirkning. Flere datasæt peger på en højere frekvens af lav fødselsvægt og for tidlig fødsel. Disse observationer kan dog meget vel fortolkes som confounding by indication. Der er beskrevet et tilfælde af medfødt nyrepåvirkning hos et barn eksponeret for 2-4 gram mesalazin under 3.-5. måned af graviditeten; men kausaliteten er tvivlsom.
Se også: Klassifikation - graviditet
Amning
Baggrund: Den relative vægtjusterede dosis er ca. 9 %, hvilket er højt. Sandsynlige bivirkninger (diarré) hos barnet er beskrevet i mindst tre tilfælde. Såfremt behandling fortsættes under amning, bør man være opmærksom på bivirkninger hos barnet.
Bloddonor
Doping

|
Ingen restriktioner |
Alkohol
Alkohol og Mesalazin "2care4" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
- Virkningsmekanismen er ikke endeligt fastlagt.
- Anti-inflammatorisk virkning opnås sandsynligvis ved, at mesalazin hæmmer leukocytchemotaxi og nedsætter cytokin- og leukotrienproduktionen samt øger dannelsen af frie radikaler.
Farmakokinetik
- < 8 % udskilles uomdannet gennem nyrerne.
- Oral administration. 30-50 % absorberes.
Depottabletter (polydepot), depotgranulat (multimatrix), enterodepottabletter (multimatrix), enterodepotgranulat (multimatrix) og tabletter med modificeret udløsning frigiver det aktive stof jævnt gennem duodenum til rectum. - Rektal administration. 10-20 % absorberes.
Egenskaber, håndtering og holdbarhed
Holdbarhed
- Opbevares beskyttet mod lys.
- Depottabletter: Må ikke opbevares i køleskab eller fryser.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Hjælpestoffer |
|---|---|---|---|
| depottabletter | 500 mg (2care4) |
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | depottabletter
500 mg
(2care4)
(kan dosisdisp.)
Mesalazin "2care4" |
057130 |
100 stk. (blister)
|
659,55 | 6,60 | 19,79 | |
| (B) | depottabletter
500 mg
(2care4)
(kan dosisdisp.)
Mesalazin "2care4" |
160456 |
300 stk. (blister)
|
1.246,90 | 4,16 | 12,47 |
Substitution
| depottabletter 500 mg |
|---|
| Pentasa Ferring, Mesalazin, depottabletter 500 mg Genordn. B |
Foto og identifikation
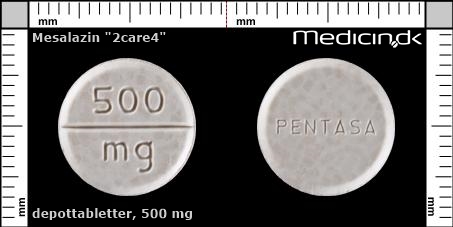
Depottabletter 500 mg (2care4) |
| Præg: |
PENTASA, mg, 500
|
| Kærv: | Delekærv |
| Farve: | Beige, Spættet, Hvid |
| Mål i mm: | 13,6 x 13,6 |
Referencer
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
4159. Rahimi R, Nikfar S, Rezaie A. Pregnancy outcome in women with inflammatory bowel disease following exposure to 5-aminosalicylic acid drugs: a meta-analysis. Reprod Toxicol. 2008; 25:271-5, https://www.ncbi.nlm.nih.gov/pubmed/18242053 (Lokaliseret 24. februar 2022)
Der kan forekomme forskelle mellem lægemiddelbeskrivelsen og indlægssedlen eller det myndighedsgodkendte produktresumé. Det skyldes, at Medicin.dk kan have suppleret Lægemiddelstyrelsens og medicinvirksomhedernes information med andre kilder. Lægemiddelbeskrivelsen og anden information i Medicin.dk’s produkter er til generel vejledning og kan ikke erstatte professionel medicinsk rådgivning.
Konsulter altid en læge eller anden sundhedsprofessionel ved spørgsmål om medicin, dosering eller behandling.
Læs mere om Brugervilkår og ansvar .



