Generel information
Anvendelsesområder
- Arteriel hypertension.
- Kardiovaskulær forebyggelse ved manifest aterotrombotisk kardiovaskulære lidelser eller ved diabetes med mindst en kardiovaskulær risikofaktor.
- Forsinkelse af udvikling og progression af diabetisk nefropati samt visse andre kroniske nefropatiformer med proteinuri.
- Hjerteinsufficiens.
- Kliniske tegn på hjertesvigt efter AMI.
Dispenseringsform
Tabletter. 1 tablet indeholder 1,25 mg, 2,5 mg (delekærv), 5 mg (delekærv) eller 10 mg (delekærv) ramipril.
Doseringsforslag
Voksne
Arteriel hypertension
- Initialt 2,5 mg 1 gang dgl.
- Efter 2-3 uger kan dosis øges op til maksimalt 10 mg 1 gang dgl.
Kardiovaskulær forebyggelse inkl. med diabetes og mindst én kardiovaskulær risikofaktor
- Initialt 2,5 mg 1 gang dgl.
- Det anbefales at fordoble dosis efter 1-2 uger og forøge dosis til 10 mg 1 gang dgl. efter endnu 2-3 uger.
- Ved samtidig diuretisk terapi gives initialt 1,25 mg dgl., alternativt seponeres diuretikumbehandlingen 3 døgn, før ramiprilbehandlingen indledes.
Diabetes og microalbuminuri
- Initialt 1,25 mg 1 gang dgl.
- Det anbefales at fordoble dosis efter 2 uger og forøge dosis til 5 mg dgl. efter endnu 2 uger.
Begyndende nefropati
- Initialt 1,25 mg 1 gang dgl.
- Det anbefales at fordoble dosis efter 2 uger og forøge dosis til 5 mg dgl. efter endnu 2 uger.
Hjerteinsufficiens
- Initialt 1,25 mg 1 gang dgl.
- Dosis fordobles med 1-2 ugers interval.
- Vedligeholdelsesdosis. Maksimalt 10 mg dgl. fordelt på 2 doser.
Profylakse efter akut myokardieinfarkt med hjerteinsufficiens
- Initialt 1,25-2,5 mg 2 gange dgl. i 2 dage.
- Dosis øges herefter til 2,5-5 mg 2 gange dgl. med 1-3 dages interval.
- Behandlingen bør indledes 2-10 dage efter det akutte myokardieinfarkt.
Bemærk:
- Ældre. Initialt 1,25 mg dgl.
- Bør ikke anvendes til børn og unge < 17 år pga. begrænsede data, erfaring savnes.
- Delekærven for tabl. 1,25 mg kan anvendes til at lette indtagelse. Det kan ikke garanteres, at en halv tablet indeholder halv dosis.
Håndtering af kapsler og tabletter
| tabletter 1,25 mg, HEXAL Delekærv for nemmere indtagelse |
| tabletter 2,5 mg, HEXAL Delekærv |
| tabletter 5 mg, HEXAL Delekærv |
| tabletter 10 mg, HEXAL Delekærv |
Mad og drikke
Tages med et glas vand.
Kan tages med eller uden mad.
Knust tablet kan kommes på kold, blød mad.
Knusning/åbning
Kan knuses.
Knust tablet har en ubehagelig smag.
Administration
Synkes hele eller halve.
Knust tablet kan opslæmmes i vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Dosisjustering
- GFR: 0-30 ml/min.
- Alder: ≥16 år
- Dosis: >5 mg
Initialdosis 1,25 mg dgl. Højst 5 mg dgl. Rutinemæssig monitorering af P-kalium og P-kreatinin.
Ved opstart accepteres et fald i eGFR på op til 30 %.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
Kontraindikationer
- Tidligere forekomst af angioneurotisk ødem under behandling med ACE-hæmmere.
- Der er krydsallergi med øvrige ACE-hæmmere.
- Samtidig behandling med aliskiren til patienter med diabetes eller med nedsat nyrefunktion, GFR < 60 ml/min.
- Samtidig behandling med sacubitril/valsartan pga. øget risiko for angioødem.
Forsigtighedsregler
- Arvelig eller idiopatisk angioødem
- Mitralklapstenose
- Aortastenose
- Hypertrofisk kardiomyopati
- Levercirrose og/eller ascites
- Nyrearteriestenose
- Bindevævssygdomme og tilstande med leuko- og trombocytopeni.
- Ekstrakorporal behandling, der fører til blodkontakt med negativt ladede overflader.
- En evt. hyponatriæmi og hypovolæmi bør korrigeres, før behandlingen indledes.
- Efter de første doser kan der komme et udtalt blodtryksfald. Risikoen er størst ved samtidig behandling med diuretika og/eller andre vasodilatorer.
Typiske alvorlige fejl
| Beskrivelse | Konsekvens |
|---|---|
| Overset nyreinsufficiens. Ingen dosistilpasning som følge af monitorering af nyrefunktion. | Nærsynkope. |
Bivirkninger
Hoste er den hyppigste bivirkning og hos 5-10 % af patienterne så generende, at behandlingen må seponeres.
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Diarré, Gastro-intestinale gener, Kvalme, Opkastning | |
| Almene symptomer og reaktioner på administrationsstedet | Træthed | |
| Infektioner og parasitære sygdomme | Infektion i nedre luftveje | |
| Metabolisme og ernæring | Hyperkaliæmi | |
| Knogler, led, muskler og bindevæv | Muskelkramper | Myalgi |
| Nervesystemet | Svimmelhed | Hovedpine |
| Det reproduktive system og mammae | Brystsmerter | |
| Luftveje, thorax og mediastinum | Dyspnø | Hoste, Sinuitis |
| Hud og subkutane væv | Makulopapuløst hududslæt | |
| Vaskulære sygdomme | Hypotension, Ortostatisk hypotension, Synkope | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Eosinofili | |
| Hjerte | Angina pectoris, Arytmier, Myokardieinfarkt | Palpitationer, Takykardi |
| Øjne | Synsforstyrrelser | |
| Mave-tarm-kanalen | Abdominalsmerter, Pancreatitis | Mundtørhed, Obstipation, Smagsforstyrrelser |
| Almene symptomer og reaktioner på administrationsstedet | Feber | |
| Immunsystemet | Angioødem | |
| Undersøgelser | Forhøjede leverenzymer | |
| Metabolisme og ernæring | Nedsat appetit | |
| Knogler, led, muskler og bindevæv | Artralgi | |
| Nervesystemet | Paræstesier | |
| Psykiske forstyrrelser | Angst, Humørforstyrrelser, Nervøsitet | Rastløshed, Søvnforstyrrelser |
| Nyrer og urinveje | Nyrefunktionspåvirkning | |
| Det reproduktive system og mammae | Erektil dysfunktion (forbigående) | Nedsat libido |
| Luftveje, thorax og mediastinum | Bronkospasme, Forværret astma | |
| Hud og subkutane væv | Hudkløe, Rødme, Øget svedtendens | |
| Vaskulære sygdomme | Perifere ødemer | |
| Sjældne (0,01-0,1 %) | ||
| Blod og lymfesystem | Agranulocytose, Trombocytopeni | |
| Øre og labyrint | Tinnitus | |
| Lever og galdeveje | Levercellenekrose | Icterus |
| Nervesystemet | Tremor | |
| Psykiske forstyrrelser | Konfusion | |
| Hud og subkutane væv | Eksfoliativ dermatitis | |
| Vaskulære sygdomme | Vasculitis | |
| Meget sjældne (< 0,01 %) | ||
| Hud og subkutane væv | Fotosensibilitet | |
| Ikke kendt hyppighed | ||
| Blod og lymfesystem | Knoglemarvsdepression | |
| Det endokrine system | Schwartz-Bartters syndrom (SIADH) | |
| Mave-tarm-kanalen | Stomatitis | |
| Almene symptomer og reaktioner på administrationsstedet | Brændende fornemmelse | |
| Lever og galdeveje | Hepatitis, Leverinsufficiens | |
| Immunsystemet | Anafylaktisk reaktion, Forværring af psoriasis, Stevens-Johnsons syndrom | |
| Metabolisme og ernæring | Hyponatriæmi | |
| Det reproduktive system og mammae | Gynækomasti | |
| Hud og subkutane væv | Alopeci, Bulløs pemfigoid, Erythema multiforme, Toksisk epidermal nekrolyse (TEN) | |
| Vaskulære sygdomme | Cerebral iskæmi, Raynauds syndrom | |
Kliniske aspekter
- Tør, irritativ hoste bedres ikke ved skift til en anden ACE-hæmmer. Skift til angiotensin II- antagonist afhjælper oftest problemet.
- Risiko for udtalt blodtryksfald er registreret hos patienter med stærkt aktiveret renin-angiotensin-aldosteron system, især i starten af behandling. Lavere startdosis kan anvendes og/eller brug af præparater med længere halveringstid.
- I tilfælde af angioneurotisk ødem er skift til anden ACE-hæmmer kontraindiceret, og man skal være varsom ved skift til AT2 receptor blokker.
- Hyperkaliæmi er især set hos ældre (> 70 år) ved samtidig behandling med kaliumbesparende diuretika/aldosteron antagonister og/eller nedsat nyrefunktion. Kontrol af p-kalium anbefales hos disse patienter.
Interaktioner
- Samtidig behandling med aliskiren er kontraindiceret til patienter med diabetes eller med nedsat nyrefunktion, GFR < 60 ml/min.
- Samtidig behandling med sacubitril/valsartan er kontraindiceret pga. øget risiko for angioødem. Behandling med sacubitril/valsartan må ikke indledes før mindst 36 timer efter sidste dosis ramipril, og behandling med ramipril må ikke indledes før mindst 36 timer efter den sidste dosis sacubitril/valsartan.
- Samtidig anvendelse af angiotensin II-receptorantagonist eller aliskiren (dobbelthæmning af renin-angiotensin-aldosteronsystemet) øger risikoen for hypotension, hyperkaliæmi og nedsat nyrefunktion.
- Ved samtidig indgift af kalium eller kaliumbesparende diuretika øges kaliumkoncentrationen i blodet på grund af ACE-hæmmernes aldosteronsekretionshæmmende virkning.
- Der er risiko for lithiumintoksikation ved samtidig indgift af lithium. Serum-lithium bør kontrolleres.
- Samtidig behandling med trimethoprim/sulfamethoxazol eller ciclosporin kan øge risikoen for hyperkaliæmi. Serum-kalium bør følges.
- NSAID (inkl. ASA > 300 mg/døgn) kan reducere den antihypertensive effekt af ACE-hæmmere og kan øge risikoen for nyrefunktionsnedsættelse.
- Det er uafklaret, om ACE-hæmmere øger insulinfølsomheden og kan medføre hypoglykæmi ved samtidig behandling med antidiabetika. Hyppig måling af blodsukkeret ved indledning og ophør af kombinationsbehandling anbefales.
- Der er øget risiko for angioødem ved samtidig behandling med mTOR-hæmmere (fx everolimus og sirolimus).
Graviditet
Baggrund: Risikoen for uønsket fosterpåvirkning ved 1. trimester eksponering for ACE-hæmmere generelt er let forhøjet sammenlignet med baggrundsrisikoen til omkring 5-6 %. Sammenlignet med ubehandlet hypertension (og justeret for andre faktorer) synes risikoen imidlertid uændret.
Må ikke anvendes i 2. og 3. trimester af graviditeten på grund af øget risiko for uønsket fosterpåvirkning, specielt i form af væksthæmning, hypocalvaria, oligohydramnios, neonatal anuri, neonatal hypotension og persisterende ductus arteriosus.
De forskellige studier omfatter sammenlagt mere end 6.700 gravide eksponeret for en ACE-hæmmer i 1. trimester af graviditeten, heraf ca. 300 for ramipril.
Se endvidere ACE-hæmmere.
Det anbefales fortsat at skifte behandlingen til et af de rekommanderede præparater; se Hypertension hos gravide.
Amning
Bloddonor
Alkohol
Alkohol og Ramipril "HEXAL" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
- Hæmmer enzymet Angiotensin Converting Enzyme og dermed omdannelsen af angiotensin I til II, hvorved universel vasodilatation indtræder.
- Virkningsvarighed ca. 24 timer.
Farmakokinetik
- Ramipril er en prodrug, som hydrolyseres i leveren til den aktive substans ramiprilat.
- Biotilgængelighed ca. 45 % (ramiprilat).
- Maksimal plasmakoncentration efter 2-4 timer (ramiprilat).
- Steady state efter ca. 4 dage.
- Plasmahalveringstid ca. 15 timer (ramiprilat).
- Udskilles hovedsageligt som ramiprilat gennem nyrerne.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| tabletter | 1,25 mg |
Andre
|
|
| 2,5 mg |
Andre
|
||
| 5 mg |
Andre
|
||
| 10 mg |
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | tabletter
1,25 mg
(kan dosisdisp.)
Ramipril "HEXAL" |
175236 |
100 stk.
|
150,00 | 1,50 | 3,00 | |
| (B) | tabletter
2,5 mg
(kan dosisdisp.)
Ramipril "HEXAL" |
064085 |
100 stk.
|
99,50 | 1,00 | 1,00 | |
| (B) | tabletter
2,5 mg
(kan dosisdisp.)
Ramipril "HEXAL" |
145521 |
100 stk. (blister)
|
99,50 | 1,00 | 1,00 | |
| (B) | tabletter
5 mg
(kan dosisdisp.)
Ramipril "HEXAL" |
436478 |
100 stk.
|
98,20 | 0,98 | 0,49 | |
| (B) | tabletter
5 mg
(kan dosisdisp.)
Ramipril "HEXAL" |
598474 |
100 stk. (blister)
|
67,15 | 0,67 | 0,34 | |
| (B) | tabletter
10 mg
(kan dosisdisp.)
Ramipril "HEXAL" |
138091 |
100 stk.
|
Udgået 21-07-2025 |
Substitution
| tabletter 1,25 mg |
|---|
| Ramipril "Krka" KRKA, Ramipril, tabletter 1,25 mg |
| Ramipril "Teva" TEVA, Ramipril, tabletter 1,25 mg |
| tabletter 2,5 mg |
|---|
| Ramipril "Krka" KRKA, Ramipril, tabletter 2,5 mg Genordn. B |
| Ramipril "Stada" STADA Nordic, Ramipril, tabletter 2,5 mg |
| Ramipril "Teva" TEVA, Ramipril, tabletter 2,5 mg |
| tabletter 5 mg |
|---|
| Ramipril "Krka" KRKA, Ramipril, tabletter 5 mg Genordn. B |
| Ramipril "Stada" STADA Nordic, Ramipril, tabletter 5 mg |
| Ramipril "Teva" TEVA, Ramipril, tabletter 5 mg |
| tabletter 10 mg |
|---|
| Ramipril "Krka" KRKA, Ramipril, tabletter 10 mg |
| Ramipril "Stada" STADA Nordic, Ramipril, tabletter 10 mg |
| Ramipril "Teva" TEVA, Ramipril, tabletter 10 mg |
Foto og identifikation
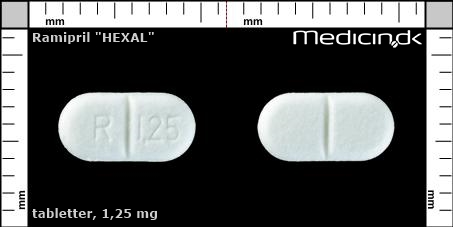
Tabletter 1,25 mg |
| Præg: |
R, 1,25
|
| Kærv: | Delekærv for nemmere indtagelse |
| Farve: | Hvid |
| Mål i mm: | 4 x 8 |
Tabletter 2,5 mg |
| Præg: |
R, 2,5
|
| Kærv: | Delekærv |
| Farve: | Hvid |
| Mål i mm: | 4 x 8 |

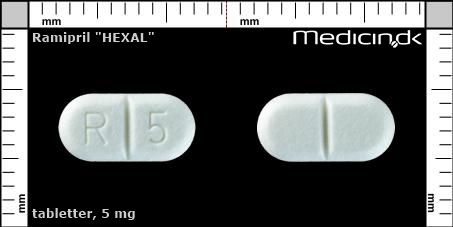
Tabletter 5 mg |
| Præg: |
R, 5
|
| Kærv: | Delekærv |
| Farve: | Hvid |
| Mål i mm: | 5 x 10 |
Tabletter 10 mg |
| Præg: |
R, 10
|
| Kærv: | Delekærv |
| Farve: | Hvid |
| Mål i mm: | 6 x 12 |

Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
3878. Briggs GG, Freeman RK, Towers CV et al. Briggs: Drugs in Pregnancy and Lactation. Wolters Kluwer. 2021; 12th Edition, https://www.wolterskluwer.com/en/solutions/ovid/briggs-drugs-in-pregnancy-and-lactation-a-reference-guide-to-fetal-and-neonatal-risk-730 (Lokaliseret 24. februar 2022)
5273. The Renal Drug Handbook. 2019; 5th. Edition, https://www.medicinainterna.net.pe/sites/default/files/The_Renal_Drug_Handbook_The_Ultimate.pdf (Lokaliseret 2. april 2025)
4331. Bateman BT, Patorno E, Desai RJ et al. Angiotensin-Converting Enzyme Inhibitors and the Risk of Congenital Malformations. Obstet Gynecol. 2017; 129(1):174-84, https://www.ncbi.nlm.nih.gov/pubmed/27926639 (Lokaliseret 3. marts 2022)
4330. Polifka JE. Is there an embryopathy associated with first-trimester exposure to angiotensin-converting enzyme inhibitors and angiotensin receptor antagonists? A critical review of the evidence. Birth Defects Res A Clin Mol Teratol. 2012; 94(8):576-98, https://www.ncbi.nlm.nih.gov/pubmed/22807387 (Lokaliseret 3. marts 2022)
4328. Li DK, Yang C, Andrade S et al. Maternal exposure to angiotensin converting enzyme inhibitors in the first trimester and risk of malformations in offspring: a retrospective cohort study. BMJ. 2011; 343, https://www.ncbi.nlm.nih.gov/pubmed/22010128 (Lokaliseret 3. marts 2022)
4329. Walfisch A, Al-maawali A, Moretti ME et al. Teratogenicity of angiotensin converting enzyme inhibitors or receptor blockers. J Obstet Gynaecol. 2011; 31(6):465-72, https://www.ncbi.nlm.nih.gov/pubmed/21823839 (Lokaliseret 3. marts 2022)
4327. Cooper WO, Hernandez-Diaz S, Arbogast PG. Major congenital malformations after first-trimester exposure to ACE inhibitors. N Engl J Med. 2006; 354(23):2443-51, https://www.ncbi.nlm.nih.gov/pubmed/16760444 (Lokaliseret 3. marts 2022)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



