Generel information
Madopar®
Anvendelsesområder
Ikke-medikamentelt betinget parkinsonisme.
Dispenseringsform
Madopar® "125", tabletter. 1 tablet (krydskærv) indeholder 25 mg benserazid (som hydrochlorid) og 100 mg levodopa,
Madopar® Quick "62,5", dispergible tabletter. 1 dispergibel tablet (delekærv) indeholder 12,5 mg benserazid (som hydrochlorid) og 50 mg levodopa,
Madopar® Quick "125", dispergible tabletter. 1 dispergibel tablet (delekærv) indeholder 25 mg benserazid (som hydrochlorid) og 100 mg levodopa,
Madopar® "62,5", kapsler, hårde. 1 kapsel indeholder 12,5 mg benserazid (som hydrochlorid) og 50 mg levodopa,
Madopar® "125", kapsler, hårde. 1 kapsel indeholder 25 mg benserazid (som hydrochlorid) og 100 mg levodopa,
Madopar® Depot, depotkapsler, hårde. 1 kapsel indeholder 25 mg benserazid (som hydrochlorid) og 100 mg levodopa.
Doseringsforslag
Tabletter og kapsler
- Initialt 50 mg levodopa/12,5 mg benserazid 3-4 gange i døgnet, øges med 100 mg levodopa/25 mg benserazid hver 3.-6. dag til optimal virkning, sædvanligvis 400 mg levodopa/100 mg benserazid - 800 mg levodopa/200 mg benserazid fordelt på 4-8* daglige doser.
- Det anbefales generelt, at dosis af levodopa holdes lavest muligt, og at der ikke stiles imod total symptomdæmpning, men imod en funktionsbedring, der tilgodeser patientens daglige behov.
- Til ældre parkinsonpatienter anbefales lavere initialdoser (50 % af ovenstående) og forsigtigere dosisstigning. Dette er særligt vigtigt, hvis der er betydende kognitive forstyrrelser, eller hvis patienten tidligere har haft konfusionstilstand.
* Grundet den korte halveringstid får patienten større effekt af 100/25 mg x 8 frem for 200/50 mg x 4. Jo lavere dosis per gang formentlig også mindre tendens til at provokere bivirkninger i form af dyskinesier.
Dispergible tabletter
- Anvendes især til behandling af patienter med dysfagi og er velegnede til dosering af patienter med naso-gastrisk sonde eller gastrostomi.
- Da det er påvist, at tiden indtil maksimal plasmakoncentration er reduceret ved anvendelse af dispergible tabletter, kan denne formulering tillige anvendes, når hurtigere indsættende effekt ønskes, fx som første dosis ved akinesi om morgenen eller ved off-tilstande, fx efter større måltider, hvor latenstiden til on-tilstand ofte er forlænget ved anvendelse af tabletter eller kapsler.
- Dispergible tabletter doseres i starten som "62,5" 1-4 gange dgl. Dosis kan øges til "125" 4-6 gange dgl.
Depotkapsler
- Ved overgang fra kapsler eller tabletter til depotkapsler startes med samme dosis og dosisinterval som ovenfor.
- Efter 2-3 dage øges dosis gradvis med yderligere 50 % på grund af mindre biotilgængelighed af depotkapslerne.
- Behovet for individuel dosistilpasning er stort, og slutdosis kan undtagelsesvis nå op på 1.600 mg levodopa/400 mg benserazid dgl.
Bemærk:
- Til ældre parkinsonpatienter anbefales lavere initialdoser (50 % af ovenstående) og forsigtigere dosisstigning. Dette er særlig vigtigt, hvis der er betydende kognitive forstyrrelser, eller hvis patienten tidligere har haft konfusionstilstand.
Håndtering af kapsler og tabletter
| hårde kapsler 100+25 mg, Roche |
| hårde kapsler 50 + 12,5 mg, Roche |
Mad og drikke
Indholdet kan kommes på blød mad, fx yoghurt eller æblemos.
Bør tages mindst 30 minutter før eller 1 time efter et måltid, da samtidig højt proteinindtag nedsætter optagelsen af levodopa.
Knusning/åbning
Kan åbnes.
Administration
Synkes hele med et glas vand.
Indholdet kan opslæmmes i vand.
Må ikke tygges.
OBS
- Gastrointestinale bivirkninger kan reduceres ved at tage dosis med et let måltid med lavt proteinindhold.
- Skal helst tages på samme måde hver dag, dvs. med eller uden mad.
| hårde depotkapsler 100+25 mg, Roche |
| hårde depotkapsler 100+25 mg, Roche (Orifarm) kærv: ikke oplyst |
| hårde depotkapsler 100+25 mg, Roche (2care4) kærv: ikke oplyst |
Mad og drikke
Bør tages mindst 30 minutter før eller 1 time efter et måltid, da samtidig højt proteinindtag nedsætter optagelsen af levodopa.
Knusning/åbning
Må ikke åbnes.
Administration
Synkes hele med et glas vand.
Må ikke tygges.
OBS
- Gastrointestinale bivirkninger kan reduceres ved at tage dosis med et let måltid med lavt proteinindhold.
- Skal helst tages på samme måde hver dag, dvs. med eller uden mad.
| tabletter 100+25 mg, Roche Krydskærv |
| tabletter 100+25 mg, Roche (Orifarm) kærv: ikke oplyst |
Mad og drikke
Knust tablet kan kommes på kold, blød mad.
Bør tages mindst 30 minutter før eller 1 time efter et måltid, da samtidig højt proteinindtag nedsætter optagelsen af levodopa.
Knusning/åbning
Kan om nødvendigt knuses.
Administration
Synkes hele med et glas vand.
Tablet kan opslæmmes i vand.
OBS
- Gastrointestinale bivirkninger kan reduceres ved at tage dosis med et let måltid med lavt proteinindhold.
- Skal helst tages på samme måde hver dag, dvs. med eller uden mad.
| dispergible tabletter 100+25 mg, Roche Delekærv |
| dispergible tabletter 50 + 12,5 mg, Roche Delekærv |
Mad og drikke
Bør tages mindst 30 minutter før eller 1 time efter et måltid.
Administration
Opløses i ½ glas vand.
OBS
- De dispergible tabletter opløses i 25 ml vand og bliver til en mælkelignende væske i løbet af få minutter. Skal drikkes inden for ½ time efter opløsning. Skyl glasset for at få bundfaldet med.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat leverfunktion
Kontraindikationer
- Svær hjerteinsufficiens
- Alvorlige hjerterytmeforstyrrelser
- Snævervinklet glaukom
- Psykiske sygdomme med psykotisk islæt
- Akutte psykoser og konfusionstilstande
- Kroniske depressioner.
- Samtidig behandling med non-selektive MAO-hæmmere (isocarboxazid, linezolid) eller selektive MAO-A-hæmmere (moclobemid). Selektive MAO B-hæmmere (fx selegilin) er ikke kontraindicerede. En kombination af selektive MAO A- og MAO B-hæmmere virker som non-selektiv MAO-hæmning og bør derfor ikke gives sammen med Madopar®.
- Patienter med alvorlige renale eller endokrine sygdomme (fx Cushings syndrom eller hypertyroidisme).
Forsigtighedsregler
- Alvorlig hjertesygdom (herunder tidligere AMI med hjertearytmi)
- Alvorlige lungesygdomme
- Astma
- Ulcussygdom (risiko for gastro-intestinal blødning)
- Kramper
- Tidligere konfusionstilstande og psykoser nødvendiggør lav dosis og langsom øgning.
- Patienter med kronisk åbenvinklet glaukom kan behandles forudsat behandling og kontrol af glaukom.
- Ved opstart af parkinson-behandling skal der gå 3 måneder, hvis patienten tidligere har haft apopleksi eller AMI.
- Ved pludselig seponering af antiparkinsonmidler er malignt neuroleptikasyndrom-lignende tilstand og rhabdomyolyse rapporteret. Patienten bør derfor observeres omhyggeligt, når levodopa reduceres pludseligt eller seponeres, især hvis patienten er i samtidig behandling med antipsykotika.
- Leverfunktion, nyrefunktion, perifert blodbillede samt homocystein, vitamin B12, folat og methylmalonat bør kontrolleres jævnligt.
- Kardiovaskulær funktion bør kontrolleres ved mistanke om påvirkning af nævnte organer.
- Patienter skal monitoreres regelmæssigt for udvikling af patologiske vane- og impulshandlinger. Det anbefales at genoverveje behandlingen, hvis disse symptomer opstår.
- Patienter under 25 år, da skelettet ikke er færdigudviklet (der kan være indikation for behandling af patienter under 25 år, fx med diagnosen dopa-responsiv dystoni).
Hjælpestoffer
Depotkapslerne indeholder soja. Læs mere om soja og overfølsomhed.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Diarré*, Kvalme, Mundtørhed, Opkastning | |
| Almene symptomer og reaktioner på administrationsstedet | Feber | |
| Infektioner og parasitære sygdomme | Infektion i øvre luftveje | |
| Undersøgelser | Ekg-forandringer | |
| Metabolisme og ernæring | Nedsat appetit | |
| Nervesystemet | Dyskinesier******, Svimmelhed | Hovedpine |
| Psykiske forstyrrelser | Agitation, Angst, Depression, Hallucinationer, Konfusion | Søvnløshed |
| Vaskulære sygdomme | Ortostatisk hypotension** | |
| Ikke almindelige (0,1-1 %) | ||
| Hjerte | Arytmier | |
| Sjældne (0,01-0,1 %) | ||
| Almene symptomer og reaktioner på administrationsstedet | Malignt neuroleptikasyndrom (ved pludselig seponering) | |
| Meget sjældne (< 0,01 %) | ||
| Nervesystemet | Uvarslede søvnanfald | |
| Nyrer og urinveje | Misfarvning af urinen | |
| Ikke kendt hyppighed | ||
| Blod og lymfesystem | Hæmolytisk anæmi, Leukopeni, Trombocytopeni | |
| Mave-tarm-kanalen | Gastro-intestinal blødning | Misfarvning af tænder og tunge, Smagsforstyrrelser |
| Undersøgelser | Forhøjede levertransaminaser | |
| Benigne, maligne og uspecificerede neoplasmer | Malignt melanom****, Planocellulært karcinom**** | |
| Psykiske forstyrrelser | Dopaminergt dysreguleringssyndrom*****, Hyperseksualitet***, Ludomani***, Tvangsspisning*** | |
| Nyrer og urinveje | Farveændring af urinen | |
| Det reproduktive system og mammae | Øget libido*** | |
| Hud og subkutane væv | Erytem | Hudkløe, Hududslæt, Øget svedtendens |
* De gastro-intestinale gener, der for det meste forekommer i begyndelsen af behandlingen, kan i de fleste tilfælde kontrolleres ved at tage levodopa-præparatet med lidt mad eller væske eller ved dosisnedsættelse og langsommere stigning, men kan også behandles med domperidon, som blokerer perifere dopaminerge receptorer. En længerevarende - i øvrigt uforklaret - diarré kan skyldes det specifikke kombinationspræparat og et skift til en anden kombination (fx fra levodopa/carbidopa til levodopa/benserazid og vice versa) kan ofte hurtigt standse diarréen.
** Ortostatisk hypotension kan også undertiden mindskes ved behandling med domperidon.
*** Disse bivirkninger, som kan ses hos parkinsonpatienter i behandling med dopaminagonister og/eller andre dopaminerge behandlinger indeholdende levodopa, er generelt reversible ved dosisreduktion eller ved seponering af behandling.
**** Undersøgelser tyder indtil videre på, at disse bivirkninger skyldes grundsygdommen og ikke den medicinske behandling.
***** Dopaminafhængighed (også kaldet det dopaminerge dysreguleringssyndrom), som er kendetegnet ved et stigende krav fra patienten om øget medicinering, der ikke er begrundet i sygdomsprogression, forekommer, men er relativ sjælden.
****** Dyskinesier er velkendte bivirkninger til levodopa behandling (LID = levodopa induced dyskinesias).
On-off fænomener skyldes formentlig en kombination af levodopas korte virkningsvarighed, nedsat absorption i mave-tarm-kanalen og det fremadskridende tab af dopamin nerveceller, hvorved oplagringen af levodopa i nervecellerne mindskes.
Interaktioner
- Alvorlige bivirkninger ved samtidig administration af non-selektive MAO-hæmmere (isocarboxazid, linezolid). Kombinationen af MAO-B- (fx selegilin) og MAO-A-hæmmere (moclobemid) virker som non-selektive MAO-hæmmere. Non-selektive MAO-hæmmere bør seponeres mindst 2 uger før behandling med levodopa.
- Der har været sjældne rapporter om bivirkninger, omfattende hypertension og i visse tilfælde dyskinesi, som skyldes samtidig administration af tricykliske antidepressiva og levodopa/ decarboxylasehæmmer.
- Sympatomimetika kan øge kardiovaskulære bivirkninger relateret til levodopa.
- Antikolinergika kan svække virkningen af levodopa på grund af langsommere absorption og forstærke dyskinesier. Der kan opstå behov for at justere dosis af levodopa. Antikolinergika må ikke seponeres brat, når behandling med levodopa-præparater påbegyndes, da det kan tage noget tid, før virkningen af levodopa sætter ind.
- Ortostatisk hypotension kan forekomme, når patienten i forvejen behandles med antihypertensiva og i kombination med selegilin og COMT-hæmmere, som kan øge biotilgængeligheden af levodopa. Dosisreduktion af levodopa-præparatet kan blive nødvendig.
- Dopamin D2-receptor antagonister (fx antipsykotika) blokerer dopaminreceptorerne og ophæver virkningen af levodopa-præparatet. Omvendt kan levodopa også nedsætte effekten af antipsykotika. Der bør udvises forsigtighed ved samtidig administration af disse lægemidler.
- Metoclopramid øger levodopas absorptionshastighed og nedsætter dets virkning. De to stoffer bør ikke anvendes sammen.
- Benzodiazepiner, isoniazid og phenytoin kan reducere den terapeutiske effekt af levodopa.
- Pyridoxin (vitamin B6) i store doser hæmmer effekten.
- Levodopa kan danne chelater med jern i mave-tarm-kanalen, hvilket medfører reduceret absorption af levodopa. Derfor bør jern og levodopa administreres med mindst 4 timers interval.
- Hos patienter med motoriske fluktuationer bør levodopa indtages 30 minutter før et proteinrigt måltid.
- Bemærk: Risiko for falsk positiv reaktion for urinketonstof og antiglobuliner (bl.a. Coombs test) og falsk negativ reaktion ved glucoseoxidasemetoder til bestemmelse af glucosuri.
Graviditet
Baggrund: Der er ikke humane data, som tillader et meningsfyldt risikoestimat.
Se også Klassifikation - graviditet
Amning
Bloddonor
Alkohol
Alkohol og Madopar® påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Symptomer på Parkinsons sygdom er - med visse undtagelser - forbundet med mangel på dopamin i de basale hjerneganglier.
Levodopa
- Decarboxyleres hurtigt efter oral indgift til dopamin (der ikke passerer blod-hjernebarrieren). Derfor vil kun en mindre mængde uomdannet levodopa nå CNS under normale forhold.
Benserazid
- Passerer ikke blod-hjernebarrieren. Hæmmer den ekstracerebrale decarboxylering af levodopa, overvejende i den intestinale mucosa. Dermed øges mængden af levodopa, som er tilgængelig for transport igennem blod-hjernebarrieren med efterfølgende omdannelse til dopamin intracerebralt.
Farmakokinetik
Benserazid
- Ca. 70 % absorberes fra mave-tarm-kanalen.
- Hydrolyseres i lever og tarmvæg til trihydroksybenzylhydrazin, der hæmmer decarboxylase.
Levodopa
- Biotilgængelighed ca. 98 % ved kombination med benserazid.
- Maksimal plasmakoncentration efter ca. 1 time.
- Depotkapslerne (polydepot) frigiver det aktive stof i op til 8 timer. Biotilgængelighed ca. 70 %.
Egenskaber, håndtering og holdbarhed
Håndtering
Kapselbeholderen skal holdes tæt tillukket for at beskytte mod fugt.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| dispergible tabletter | 50 + 12,5 mg |
Benserazid (12,5 mg)
Levodopa (50 mg)
|
Andre
|
| 100+25 mg |
Benserazid (25 mg)
Levodopa (100 mg)
|
Andre
|
|
| hårde depotkapsler | 100+25 mg |
Benserazid (25 mg)
Levodopa (100 mg)
|
Farve
Andre
|
| 100+25 mg (Orifarm) |
Benserazid (25 mg)
Levodopa (100 mg)
|
Farve
Andre
|
|
| 100+25 mg (2care4) |
Benserazid (25 mg)
Levodopa (100 mg)
|
Farve
Andre
|
|
| hårde kapsler | 100+25 mg |
Benserazid (25 mg)
Levodopa (100 mg)
|
Farve
Andre
|
| 50 + 12,5 mg |
Benserazid (12,5 mg)
Levodopa (50 mg)
|
Farve
Andre
|
|
| tabletter | 100+25 mg |
Benserazid (25 mg)
Levodopa (100 mg)
|
Farve
Andre
|
| 100+25 mg (Orifarm) |
Benserazid (25 mg)
Levodopa (100 mg)
|
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | tabletter
100+25 mg
Madopar® "125"
(kan dosisdisp.)
Madopar "125" |
037358 |
100 stk.
|
195,35 | 1,95 | 11,72 | |
| (B) | tabletter
100+25 mg
(Orifarm)
Madopar 125 |
087626 |
100 stk.
|
384,95 | 3,85 | 23,10 | |
| (B) | dispergible tabletter
50 + 12,5 mg
Madopar Quick 62,5 |
444430 |
100 stk.
|
161,65 | 1,62 | 19,40 | |
| (B) | dispergible tabletter
100+25 mg
Madopar Quick 125 |
372151 |
100 stk.
|
209,10 | 2,09 | 12,55 | |
| (B) | hårde kapsler
100+25 mg
(kan dosisdisp.)
Madopar "125" |
502047 |
100 stk.
|
143,55 | 1,44 | 8,61 | |
| (B) | hårde kapsler
50 + 12,5 mg
(kan dosisdisp.)
Madopar "62,5" |
117564 |
100 stk.
|
108,60 | 1,09 | 13,03 | |
| (B) | hårde depotkapsler
100+25 mg
(Orifarm)
(kan dosisdisp.)
Madopar Depot |
430166 |
90 stk. (3 x 30)
|
Udgået 09-06-2025 | |||
| (B) | hårde depotkapsler
100+25 mg
(kan dosisdisp.)
Madopar Depot |
492405 |
100 stk.
|
178,70 | 1,79 | 10,72 | |
| (B) | hårde depotkapsler
100+25 mg
(2care4)
(kan dosisdisp.)
Madopar Depot |
198957 |
120 stk.
|
222,00 | 1,85 | 11,10 |
Substitution
| tabletter 100+25 mg |
|---|
| Levodopa/Benserazid "Orifarm" Orifarm Generics, Benserazid, Levodopa, tabletter 100+25 mg |
| Levodopa/Benserazid "Teva" TEVA, Benserazid, Levodopa, hårde kapsler 100+25 mg |
| Madopar "125" Roche, Benserazid, Levodopa, hårde kapsler 100+25 mg |
| hårde kapsler 100+25 mg |
|---|
| Levodopa/Benserazid "Orifarm" Orifarm Generics, Benserazid, Levodopa, tabletter 100+25 mg |
| Levodopa/Benserazid "Teva" TEVA, Benserazid, Levodopa, hårde kapsler 100+25 mg |
| Madopar "125" Roche, Benserazid, Levodopa, tabletter 100+25 mg |
| hårde kapsler 50 + 12,5 mg |
|---|
| Levodopa/Benserazid "Teva" TEVA, Benserazid, Levodopa, hårde kapsler 50+12,5 mg |
Foto og identifikation
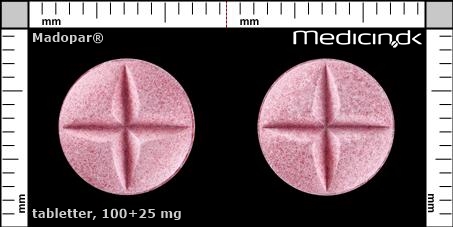
Tabletter 100+25 mg |
| Præg: |
Intet præg
|
| Kærv: | Krydskærv |
| Farve: | Lyserød |
| Mål i mm: | 10,1 x 10,1 |
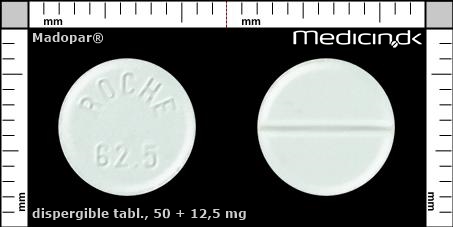
Dispergible tabletter 50 + 12,5 mg |
| Præg: |
ROCHE, 62,5
|
| Kærv: | Delekærv |
| Farve: | Hvid |
| Mål i mm: | 9 x 9 |
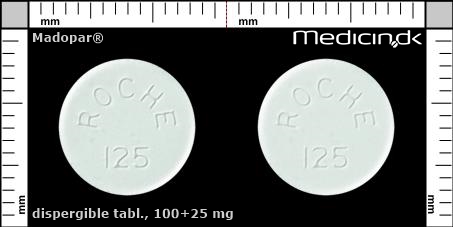
Dispergible tabletter 100+25 mg |
| Præg: |
ROCHE, 125
|
| Kærv: | Delekærv |
| Farve: | Hvid |
| Mål i mm: | 11,1 x 11,1 |
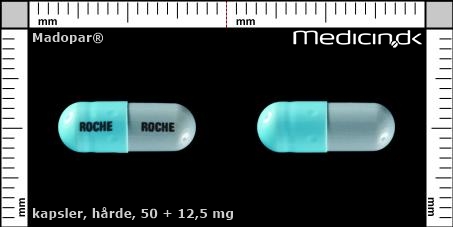
Hårde kapsler 50 + 12,5 mg |
| Præg: |
ROCHE
|
| Kærv: | Ikke relevant |
| Farve: | Blå, Grå |
| Mål i mm: | 5 x 13,9 |
Hårde kapsler 100+25 mg |
| Præg: |
ROCHE
|
| Kærv: | Ikke relevant |
| Farve: | Lyserød, Blå |
| Mål i mm: | 6 x 17,6 |
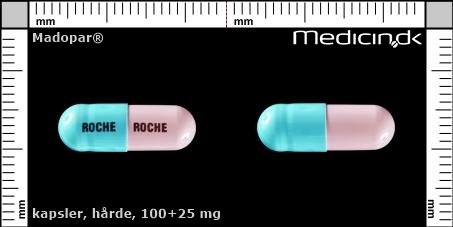
Hårde depotkapsler 100+25 mg |
| Præg: |
ROCHE
|
| Kærv: | Ikke relevant |
| Farve: | Grøn, Blå |
| Mål i mm: | 6,5 x 19 |

Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
3773. LiverTox. 2022, https://livertox.nih.gov/ (Lokaliseret 24. februar 2022)
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
3787. Carranza M, Snyder MR, Shaw JD et al. Parkinson's Disease. A Guide to Medical Treatment. Seed Medical Publishers. 2013; 1st Edition, https://www.seedstm.com/wp-content/uploads/preview/Parkinsons_Disease.pdf (Lokaliseret 10. november 2023)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



