Generel information
Kolinesterasehæmmer. Middel til behandling af demens. Carbamatderivat.
Anvendelsesområder
Anvendes ved Alzheimers sygdom, Lewy Body demens og demens ved Parkinsons sygdom, alle i let til svær grad. Se endvidere Demens.
Dispenseringsform
Kapsler, hårde. 1 kapsel indeholder 1,5 mg eller 3 mg rivastigmin (som hydrogentartrat).
Doseringsforslag
Voksne.
Initialt 1,5 mg 2 gange dgl. i forbindelse med et måltid. Hvis dosis tolereres, kan den øges efter mindst to ugers (4 uger anbefales) behandling til 3 mg 2 gange dgl. og evt. yderligere med mindst to ugers intervaller til 4,5 mg 2 gange dgl. og 6 mg 2 gange dgl., som er maksimal døgndosis.
Hvis behandlingen afbrydes mere end 3 dage, skal behandlingen genoptages med 1,5 mg 2 gange dgl.
Skift fra depotplastre til oral behandling ved kontaktdermatitis
Ved evt. skift fra depotplastre til oral behandling pga. kontaktdermatitis, skal der først foretages allergitest. Tilfælde af sensibilisering over for rivastigmin med allergiske reaktioner også ved oral behandling er set.
Bemærk:
- Kapslerne tages med et glas vand.
- Kapslerne kan åbnes.
- Indholdet kan opslæmmes i vand.
- Indholdet kan kommes på kold, blød mad.
- Tages til et måltid.
- Patienten bør som hovedregel have en omsorgsperson (kan være fra hjemmeplejen), som hjælper med at håndtere medicineringen.
Håndtering af kapsler og tabletter
| hårde kapsler 1,5 mg, Viatris |
| hårde kapsler 3 mg, Viatris |
Mad og drikke
Tages til et måltid.
Indholdet kan kommes på kold, blød mad.
Knusning/åbning
Kan åbnes.
Administration
Synkes hele med et glas vand.
Indholdet kan opslæmmes i vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat leverfunktion
- Efter oral indgift er set mere end fordobling af AUC hos personer med let til moderat nedsat leverfunktion (Child-Pugh 5-12).
- Øget risiko for dosisafhængige bivirkninger ved klinisk betydende nedsat leverfunktion. Erfaring savnes ved stærkt nedsat leverfunktion.
- Særlig opmærksomhed på bivirkninger ved dosistitrering anbefales.
Kontraindikationer
Overfølsomhed over for andre carbamatderivater som fx carisoprodol, neostigmin, physostigmin og pyridostigmin.
Forsigtighedsregler
Astma og KOL
Forsigtighed anbefales. Risiko for forværring af luftvejsobstruktion pga. den kolinerge effekt.
Risiko for bradykardi og forlænget QT-interval
Rivastigmin kan medføre forlænget QT-interval og bradykardi og bør anvendes med forsigtighed ved eksisterende bradykardi og forlænget QT-interval samt ved øget risiko for bradykardi eller QT-forlængelse (fx andre QT-forlængende lægemidler, elektrolytforstyrrelser, familiær anamnese). Desuden forsigtighed ved syg sinusknude-syndrom eller andre supraventrikulære overledningsforstyrrelser i hjertet.
Monitorering af vægt
Patientens vægt bør følges, da behandling med kolinesterasehæmmere kan øge risikoen for vægttab (NB: gastro-intestinale bivirkninger er hyppigst ved oral behandling).
Ulcussygdomme
Anvendes med forsigtighed ved ulcus duodeni eller ventriculi, da den kolinerge virkning kan medføre øget sekretion af mavesyre.
Urinretention
På grund af den kolinerge effekt kan urinretention forværres. Forsigtighed ved prostatahypertrofi.
Typiske alvorlige fejl
| Beskrivelse | Konsekvens |
|---|---|
| Initialbehandling sker med for høj dosis (vedligeholdelsesdosis) uden hensyn til optrapningsregime. | Overdosering. Indlæggelse |
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Dyspepsi, Kvalme, Opkastning |
| Almene symptomer og reaktioner på administrationsstedet | Kraftesløshed, Temperaturstigning, Træthed | |
| Traumer, forgiftninger og behandlingskomplikationer | Reaktioner og ubehag på applikationsstedet (fx erytem og dermatitis) | |
| Undersøgelser | Vægttab | |
| Metabolisme og ernæring | Nedsat appetit | |
| Nervesystemet | Svimmelhed | Hovedpine |
| Psykiske forstyrrelser | Agitation, Angst, Delirium, Depression, Spisevægring | |
| Nyrer og urinveje | Inkontinens, Urinvejsinfektion | |
| Hud og subkutane væv | Hududslæt | |
| Vaskulære sygdomme | Synkope | |
| Ikke almindelige (0,1-1 %) | ||
| Hjerte | Bradykardi | |
| Mave-tarm-kanalen | Gastro-duodenale ulcera | |
| Metabolisme og ernæring | Dehydrering | |
| Psykiske forstyrrelser | Aggressivitet, Hyperaktivitet | |
| Sjældne (0,01-0,1 %) | ||
| Traumer, forgiftninger og behandlingskomplikationer | Faldtendens | |
| Meget sjældne (< 0,01 %) | ||
| Nervesystemet | Ekstrapyramidale gener | |
| Ikke kendt hyppighed | ||
| Hjerte | Atrieflimren, AV-blok, Syg Sinus Syndrom | Takykardi |
| Mave-tarm-kanalen | Pancreatitis | |
| Lever og galdeveje | Hepatitis | |
| Immunsystemet | Urticaria | |
| Undersøgelser | Forhøjede leverenzymer* | |
| Knogler, led, muskler og bindevæv | Kramper | |
| Nervesystemet | Forværring af parkinsonisme, Pleurothotonus, Tremor | |
| Psykiske forstyrrelser | Hallucinationer | Døsighed, Mareridt, Rastløshed |
| Hud og subkutane væv | Erytem | Allergisk dermatitis, Blærer, Hudkløe |
| Vaskulære sygdomme | Hypertension | |
* Seponering bør overvejes ved leverinsufficiens uden anden kendt årsag.
- De anførte bivirkninger er gældende ved transdermal administration.
- Ved oral administration ses GI-relaterede bivirkninger meget almindeligt (> 10 %) og der er set tilfælde af alvorlig opkastning associeret med øsofagusruptur.
Kliniske aspekter
- De fleste patienter tåler behandlingen godt uden nævneværdige bivirkninger. På trods af dette vil ca. 10 %, der tager kolinesterasehæmmerne, ophører på grund af bivirkninger.
- I praksis ses der flest GI-bivirkninger (særligt kvalme og diarré), der oftest forekommer ifm. behandlingsopstart og evt. dosisøgning og svinder efter nogle dage. Indtag med mad kan modvirke kvalme. Dosering til natten kan evt. forsøges, da patienten i så tilfælde sover, mens bivirkninger som kvalme er værst.
GI-bivirkningerne forekommer betydeligt hyppigere ved oral administration (hos over 10 %) og ses oftere hos kvinder end hos mænd.
- Nedsat appetit medførende vægttab, er også en hyppigt forekommende bivirkning.
Det er vigtigt at være opmærksom på evt. vægttab, da det ofte ikke rapporteres eller opfattes af patienten og da pårørende heller ikke altid er opmærksomme på dette, eller forbinder det med bivirkninger. Ved mistanke om vægttab bør patientens vægt monitoreres og fx ernæringstilskud kan overvejes.
Støtte og rådgivning under optrapning er afgørende for at undgå problematisk vægttab, men seponering eller, ved brug af kapsler, præparatskift til plasterbehandling, kan være nødvendig.
- Søvnløshed og abnorme drømme vil normalt mindskes ved fortsat behandling, men kan ellers modvirkes ved dosering om morgenen. Man bør være opmærksom på, at grundsygdommen i sig selv kan medføre søvnforstyrrelser. Det er ikke altid, at patienterne oplever de livlige drømme som problematiske.
- Pga. stimulering af mavesyreudskillelsen, kan der forekomme GI-blødning og -ulcerationer. Behandling med en PPI kan overvejes i disse tilfælde.
- Risikoen for bradykardi og synkope kan øges ved samtidig behandling med midler, der kan sænke hjerterytmen som fx betablokkere og visse antiarytmika. Forsigtighed ved overledningsforstyrrelser som 1. grads AV-blok eller andre blok.
- Nogle patienter oplever rhinnorré af behandlingen, som kan være irriterende.
- Præparatskift kan forsøges ved bivirkninger, men der er ikke evidens for, at bivirkningsprofilen er forskellig imellem de forskellige kolinesterasehæmmere. Ved anvendelse af kapsler og forekomst af GI-bivirkninger, kan plasterbehandling overvejes.
- Skrøbelige patienter (fx. grundet lav vægt, demenssygdommen eller andre komorbiditeter) har en højere risiko for bivirkninger. Øget forekomst af bivirkninger kan fx. ses ved nedsat lever- eller nyrefunktion samt ved legemsvægt under 50 kg.
- Patienter med demens har ofte nedsat egenomsorg og reduceret sygdomsindsigt. Derfor bør der udspørges om specifikke bivirkninger, og altid forsøges at skaffe oplysninger fra pårørende også. Hvis det er muligt med andre midler at overvåge bivirkninger (fx. vejning) bør dette anvendes.
Interaktioner
- Rivastigmin kan forstærke virkningen af depolariserende muskelrelaksantia.
- På grund af de farmakodynamiske virkninger bør rivastigmin ikke gives samtidig med andre lægemidler med kolinerg virkning.
- Delirium er set ved samtidig indgift af tolterodin, hvilket muligvis alene skyldes den antikolinerge effekt af tolterodin.
- Forsigtighed ved kombination med β-receptorblokerende midler pga. øget risiko for bradykardi samt ved kombination med midler, der kan forlænge QTc-intervallet (se Antiarytmika).
Graviditet
Der foreligger ikke kliniske data om eksponering for rivastigmin under graviditet. Den potentielle risiko for mennesker er ukendt.
Amning
Ikke indiceret til ammende. Det vides ikke, om rivastigmin udskilles i human mælk.
Bloddonor
Alkohol
Alkohol og Rivastigmin "Viatris" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Forgiftning
Kolinergt toksidrom.
Behandling: Massiv overdosering kan behandles med atropin, evt. gentaget afhængig af effekt.
Bemærk: Ved snævervinklet glaukom skal øjnene dryppes med pilocarpin 2 % samtidig med injektion af atropin.
Farmakodynamik
Specifik og pseudoirreversibel hæmmer af acetyl- og butyrylkolinesterase. Virker overvejende centralt. Forbedrer kognitive funktioner og patientens samlede (globale) funktion. Forhindrer ikke sygdomsprogressionen, men forsinker symptomudviklingen.
Kolinesterasehæmningen varer ca. 9 timer.
Farmakokinetik
- Metaboliseres hurtigt og fuldstændigt til inaktive metabolitter.
- Plasmahalveringstid ca. 1 time.
- Oral administration. Biotilgængelighed ca. 35 % (fastende) og øges med ca. 30 % ved samtidig fødeindtagelse. Maksimal plasmakoncentration efter ca. 1 time.
- Transdermal administration. Maksimal plasmakoncentration efter 10-16 timer med efterfølgende langsomt fald over den resterende 24-timers behandlingsperiode.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| hårde kapsler | 1,5 mg |
Farve
Andre
|
|
| 3 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (A) | hårde kapsler
1,5 mg
(kan dosisdisp.)
Rivastigmin "Viatris" |
035875 |
56 stk. (blister)
|
Udgået 28-04-2025 | |||
| (A) | hårde kapsler
1,5 mg
(kan dosisdisp.)
Rivastigmin "Viatris" |
064141 |
56 stk. (blister)
|
66,90 | 1,19 | 7,17 | |
| (A) | hårde kapsler
3 mg
(kan dosisdisp.)
Rivastigmin "Viatris" |
057009 |
56 stk. (blister)
|
Udgået 28-04-2025 | |||
| (A) | hårde kapsler
3 mg
(kan dosisdisp.)
Rivastigmin "Viatris" |
156339 |
56 stk. (blister)
|
105,35 | 1,88 | 5,64 |
Substitution
| hårde kapsler 1,5 mg |
|---|
| Nimvastid KRKA, Rivastigmin, hårde kapsler 1,5 mg |
| hårde kapsler 3 mg |
|---|
| Nimvastid KRKA, Rivastigmin, hårde kapsler 3 mg |
| Rivastigmin "Orion" Orion Pharma, Rivastigmin, hårde kapsler 3 mg |
Foto og identifikation
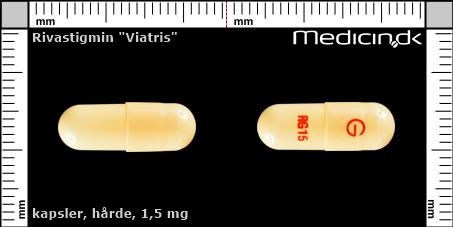
Hårde kapsler 1,5 mg |
| Præg: |
RG 15, G
|
| Kærv: | Ikke relevant |
| Farve: | Gul |
| Mål i mm: | 6,3 x 17,8 |
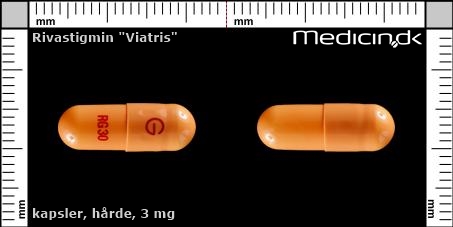
Hårde kapsler 3 mg |
| Præg: |
RG 30, G
|
| Kærv: | Ikke relevant |
| Farve: | Orange |
| Mål i mm: | 6,4 x 17,5 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
3796. Dunn NR, Pearce GL, Shakir SA. Adverse effects associated with the use of donepezil in general practice in England. J Psychopharmacol. 2000; 14(4):406-8, https://www.ncbi.nlm.nih.gov/pubmed/11198060 (Lokaliseret 24. februar 2022)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



